早教吧作业答案频道 -->化学-->
煤燃烧后的主要产物是CO、CO2.(1)已知:①C(s)+H2O(g)⇌CO(g)+H2(g)△H1=+131.3KJ/mol②C(s)+2H2O(g)⇌CO2(g)+2H2(g)△H2=+90.0kJ/mol③CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3△H3=kJ/mol
题目详情
煤燃烧后的主要产物是CO、CO2.
(1)已知:①C(s)+H2O(g)⇌CO(g)+H2(g)△H1=+131.3KJ/mol
②C(s)+2H2O(g)⇌CO2(g)+2H2(g)△H2=+90.0kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3
△H3=___kJ/mol,在反应①的体系中加入催化剂,△Hl___(填“增大”“减小”或“不变”).
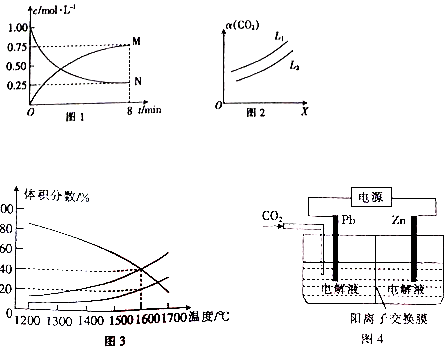
(2)以CO2为原料可制备甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ/mol,向1L 的恒容密闭容器中充入1molCO2(g)和3mol H2(g),测得CO2(g)和CH3OH(g)浓度随时间的变化如图1 所示.
①图1中N表示的是___(填化学式);0~8min内,以氢气表示的平均反应速率v(H2)=___mol/(L•min).
②在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如图2 所示,L和X分别表示温度或压强.X表示的物理量是___(填“温度”或“压强”),Ll ___(填“>”或“<”) L2.
(3)向一体积为20L的恒容密闭容器中通入1molCO2发生反应2CO2(g)═2CO(g)+O2(g),在不同温度下各物质的体积分数变化如图3所示.1600℃时反应达到平衡,则此时反应的平衡常数K=___.
(4)草酸锌可应用于有机合成、电子工业等.工业上制取ZnC2O4的原理如图4所示(电解液不参加反应),Zn电极是___(填“正”“负”“阴”或“阳”)极.已知在Pb电极区得到ZnC2O4,则Pb电极上的电极反应式为___.

(1)已知:①C(s)+H2O(g)⇌CO(g)+H2(g)△H1=+131.3KJ/mol
②C(s)+2H2O(g)⇌CO2(g)+2H2(g)△H2=+90.0kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3
△H3=___kJ/mol,在反应①的体系中加入催化剂,△Hl___(填“增大”“减小”或“不变”).
(2)以CO2为原料可制备甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ/mol,向1L 的恒容密闭容器中充入1molCO2(g)和3mol H2(g),测得CO2(g)和CH3OH(g)浓度随时间的变化如图1 所示.
①图1中N表示的是___(填化学式);0~8min内,以氢气表示的平均反应速率v(H2)=___mol/(L•min).
②在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如图2 所示,L和X分别表示温度或压强.X表示的物理量是___(填“温度”或“压强”),Ll ___(填“>”或“<”) L2.
(3)向一体积为20L的恒容密闭容器中通入1molCO2发生反应2CO2(g)═2CO(g)+O2(g),在不同温度下各物质的体积分数变化如图3所示.1600℃时反应达到平衡,则此时反应的平衡常数K=___.
(4)草酸锌可应用于有机合成、电子工业等.工业上制取ZnC2O4的原理如图4所示(电解液不参加反应),Zn电极是___(填“正”“负”“阴”或“阳”)极.已知在Pb电极区得到ZnC2O4,则Pb电极上的电极反应式为___.
▼优质解答
答案和解析
(1)已知:①C(s)+H2O(g)⇌CO(g)+H2(g)△H1=+131.3KJ/mol
②C(s)+2H2O(g)⇌CO2(g)+2H2(g)△H2=+90.0kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3
盖斯定律计算①-②得到CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3=+41.3kJ/mol,
在反应①的体系中加入催化剂,催化剂改变化学反应速率不改变化学平衡,反应的△H1不变,
故答案为:+41.3;不变;
(2)①结合化学平衡三行计算列式计算,向1L 的恒容密闭容器中充入1molCO2(g)和3mol H2(g),测得CO2(g)和CH3OH(g)浓度随时间的变化如图1 所示,N起始量为1.00mol/L为二氧化碳,平衡后二氧化碳的为0.25mol/L,物质的量为0.25mol,
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) 0.75 2.25 0.75 0.75
平衡量(mol) 0.25 0.75 0.75 0.75
反应速率v(H2)=
=
=0.28mol/(L•min);
故答案为:CO2;0.28;
②在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如图2 所示,L和X分别表示温度或压强,反应为气体体积减小的放热反应,利用平衡影响原理分析,升温平衡想吸热反应方向进行,增大压强平衡向气体体积减小的方向进行,图象可知X增大CO2的平衡转化率(α),说明平衡正向进行则X为增大压强,L为温度变化,温度升高平衡逆向进行,二氧化碳转化率越大,温度越低,则L1<L2,
故答案为:压强;<;
(3))向一体积为20L的恒容密闭容器中通入1molCO2发生反应2CO2(g)═2CO(g)+O2(g),在不同温度下各物质的体积分数变化如图3所示.图象中1600°C减少的为二氧化碳,平衡体积分数为40%,1600℃时反应达到平衡,
设二氧化碳消耗浓度为x,
2CO2(g)═2CO(g)+O2(g)
起始量(mol/L) 0.05 0 0
变化量(mol/L) x x 0.5x
平衡量(mol/L) 0.05-x x 0.5x
=40%
x=0.025mol/L
平衡常数K=
=0.0125,
故答案为:0.0125;
(4)利用电化学还原CO2制取ZnC2O4,则Zn失电子,所以Zn在阳极上失电子生成锌离子,即锌与正极相连为阳极;Pb电极上CO2得电子生成C2O42-,则其电极反应为:2CO2+2e-=C2O42-;
故答案为:阳;2CO2+2e-=C2O42-.
②C(s)+2H2O(g)⇌CO2(g)+2H2(g)△H2=+90.0kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3
盖斯定律计算①-②得到CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3=+41.3kJ/mol,
在反应①的体系中加入催化剂,催化剂改变化学反应速率不改变化学平衡,反应的△H1不变,
故答案为:+41.3;不变;
(2)①结合化学平衡三行计算列式计算,向1L 的恒容密闭容器中充入1molCO2(g)和3mol H2(g),测得CO2(g)和CH3OH(g)浓度随时间的变化如图1 所示,N起始量为1.00mol/L为二氧化碳,平衡后二氧化碳的为0.25mol/L,物质的量为0.25mol,
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) 0.75 2.25 0.75 0.75
平衡量(mol) 0.25 0.75 0.75 0.75
反应速率v(H2)=
| △c |
| △t |
| ||
| 8min |
故答案为:CO2;0.28;
②在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如图2 所示,L和X分别表示温度或压强,反应为气体体积减小的放热反应,利用平衡影响原理分析,升温平衡想吸热反应方向进行,增大压强平衡向气体体积减小的方向进行,图象可知X增大CO2的平衡转化率(α),说明平衡正向进行则X为增大压强,L为温度变化,温度升高平衡逆向进行,二氧化碳转化率越大,温度越低,则L1<L2,
故答案为:压强;<;
(3))向一体积为20L的恒容密闭容器中通入1molCO2发生反应2CO2(g)═2CO(g)+O2(g),在不同温度下各物质的体积分数变化如图3所示.图象中1600°C减少的为二氧化碳,平衡体积分数为40%,1600℃时反应达到平衡,
设二氧化碳消耗浓度为x,
2CO2(g)═2CO(g)+O2(g)
起始量(mol/L) 0.05 0 0
变化量(mol/L) x x 0.5x
平衡量(mol/L) 0.05-x x 0.5x
| 0.05-x |
| 0.05-x+x+0.5x |
x=0.025mol/L
平衡常数K=
| 0.025×0.5×0.0252 |
| (0.05-0.025)2 |
故答案为:0.0125;
(4)利用电化学还原CO2制取ZnC2O4,则Zn失电子,所以Zn在阳极上失电子生成锌离子,即锌与正极相连为阳极;Pb电极上CO2得电子生成C2O42-,则其电极反应为:2CO2+2e-=C2O42-;
故答案为:阳;2CO2+2e-=C2O42-.
看了 煤燃烧后的主要产物是CO、C...的网友还看了以下: