早教吧作业答案频道 -->化学-->
铁及其化合物在工农业生产中有重要的作用.(1)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1②C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1③4Fe(s)+3O3(g)=2Fe2O3(s)△H3=-1651.0kJ•mol-1CO
题目详情
铁及其化合物在工农业生产中有重要的作用.
(1)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
②C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
③4Fe(s)+3O3(g)=2Fe2O3 (s)△H3=-1651.0kJ•mol-1
CO还原氧化铁的热化学方程式为___.
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理如下:CO(g)+2H2(g)⇌CH3OH(g)△H.在体积不同的两个恒容密闭容器中分别充入1molCO和2moL H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图1.
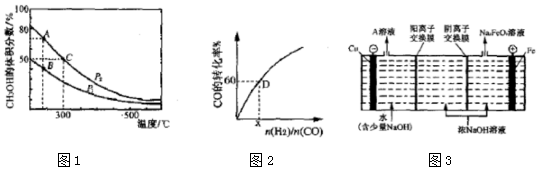
①在图1A、B、C三点中,选填表物理量对应最大的点.
②在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25mol的 CH3OH,该反应向___方向进行(填“正反应”、“逆反应”或“不移动”).
③一定温度下,CO的转化率与起始投料比[
]的变化关系如图2所示,测得D点氢气的转化率为40%,则x=___.
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板.某腐蚀废液中含有 0.5mol•L-l Fe3+ 和0.26mol•L-1 的 Cu2+,欲使 Fe3+完全沉淀[c(Fe3+)<4×10-5 mol•L-1]而Cu2+不沉淀,则需控制溶液 pH 的范围为___.[KSp(Cu(OH)2=2.6×10-19;Ksp(Fe(OH)3=4×10-38;
(4)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,工业上通过电解浓 NaOH溶液可制备Na2FeO4,然后转化为K2FeO4,电解原理如图3所示.
则A溶液中溶质的成分为___(填化学式);阳极的电极反应式为___.
(1)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
②C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
③4Fe(s)+3O3(g)=2Fe2O3 (s)△H3=-1651.0kJ•mol-1
CO还原氧化铁的热化学方程式为___.
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理如下:CO(g)+2H2(g)⇌CH3OH(g)△H.在体积不同的两个恒容密闭容器中分别充入1molCO和2moL H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图1.

①在图1A、B、C三点中,选填表物理量对应最大的点.
| 反应速率v | 平衡常数K | 平衡转化率α |
③一定温度下,CO的转化率与起始投料比[
| n(H2) |
| n(CO) |
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板.某腐蚀废液中含有 0.5mol•L-l Fe3+ 和0.26mol•L-1 的 Cu2+,欲使 Fe3+完全沉淀[c(Fe3+)<4×10-5 mol•L-1]而Cu2+不沉淀,则需控制溶液 pH 的范围为___.[KSp(Cu(OH)2=2.6×10-19;Ksp(Fe(OH)3=4×10-38;
(4)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,工业上通过电解浓 NaOH溶液可制备Na2FeO4,然后转化为K2FeO4,电解原理如图3所示.
则A溶液中溶质的成分为___(填化学式);阳极的电极反应式为___.
▼优质解答
答案和解析
(1)将方程式
得Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),
△H=
=
kJ/mol=-23.5 kJ.mol-1,
故答案为:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-23.5 kJ.mol-1;
(2)①该反应是一个反应前后气体体积减小的可逆反应,增大压强平衡正向移动,则甲醇含量增大,根据图知,比较A和B点知,相同温度、不同压强下,A点甲醇体积分数大于B点,说明压强P2>P1,压强越大、温度越高,化学反应速率越快,A、C压强相同且大于B点压强,温度C点最高,所以反应速率最快的是C点;
化学平衡常数只与温度有关,根据图知,温度越高,甲醇含量越低,说明平衡逆向移动,则正反应是放热反应,温度越高,化学平衡常数越小,C点温度高于A和B点且AB点温度相同,所以化学平衡常数最大的是AB;
甲醇的含量越大,则反应物转化率越大,所以甲醇转化率最大的是A点;
故答案为:C;AB;A;
②C点甲醇的体积分数为50%,即甲醇的物质的量分数为50%,设反应掉的n(CO)=xmol,
CO(g)+2H2(g)⇌CH3OH
1mol 2mol 0
xmol 2xmol xmol
(1-x)mol 2(1-x)mol xmol
×100%=50%
x=0.75
设容器体积为1L,则平衡时c(CH3OH)=0.75mol/L、c(CO)=0.25mol/L、c(H2)=0.50mol/L,化学平衡常数K=
=12,
向C点平衡体系中再充入0.25molCO、0.5molH2和0.25mol的 CH3OH,此时c(CH3OH)=1mol/L、c(CO)=0.50mol/L、c(H2)=1mol/L,浓度商=
=2<K,则平衡正向移动,
故答案为:正反应;
③设n(H2)=amol、n(CO)=bmol,氢气的转化率为40%、CO的转化率为60%,根据方程式知,参加反应的n(CO)为参加反应的n(H2)的一半,所以40%amol=2bmol×60%,x=3,
故答案为:3;
(3)Fe3+完全沉淀时c(OH-)3=
=
(mol/L)3=1×10-33 (mol/L)3,此时c(OH-)=10-11 mol/L,pH=3;Cu2+沉淀时c(OH-)2=
(mol/L)2=
(mol/L)2=1×10-18 (mol/L)2,c(OH-)=10-9 mol/L,pH=5,所以控制溶液的pH范围为3≤pH<5,
故答案为:3≤pH<5;
(4)Cu电极是阴极,阴极上电极反应式为2H2O+2e-=H2↑+2OH-,浓NaOH溶液中钠离子通过阳离子交换膜进入阴极室,所以阴极室溶液中溶质为NaOH;阳极上Fe失电子和OH-反应生成Na2FeO4,电极反应式为,
故答案为:NaOH; Fe-6e-+8OH-=FeO42-+4H2O.
| 3(①-②)-③ |
| 2 |
△H=
| 3(△H1-△H2)-△H3 |
| 2 |
| 3(-393.5-172.5)-(-1651.0) |
| 2 |
故答案为:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-23.5 kJ.mol-1;
(2)①该反应是一个反应前后气体体积减小的可逆反应,增大压强平衡正向移动,则甲醇含量增大,根据图知,比较A和B点知,相同温度、不同压强下,A点甲醇体积分数大于B点,说明压强P2>P1,压强越大、温度越高,化学反应速率越快,A、C压强相同且大于B点压强,温度C点最高,所以反应速率最快的是C点;
化学平衡常数只与温度有关,根据图知,温度越高,甲醇含量越低,说明平衡逆向移动,则正反应是放热反应,温度越高,化学平衡常数越小,C点温度高于A和B点且AB点温度相同,所以化学平衡常数最大的是AB;
甲醇的含量越大,则反应物转化率越大,所以甲醇转化率最大的是A点;
故答案为:C;AB;A;
②C点甲醇的体积分数为50%,即甲醇的物质的量分数为50%,设反应掉的n(CO)=xmol,
CO(g)+2H2(g)⇌CH3OH
1mol 2mol 0
xmol 2xmol xmol
(1-x)mol 2(1-x)mol xmol
| xmol |
| (1-x)mol+2(1-x)mol+xmol |
x=0.75
设容器体积为1L,则平衡时c(CH3OH)=0.75mol/L、c(CO)=0.25mol/L、c(H2)=0.50mol/L,化学平衡常数K=
| 0.75 |
| 0.25×0.502 |
向C点平衡体系中再充入0.25molCO、0.5molH2和0.25mol的 CH3OH,此时c(CH3OH)=1mol/L、c(CO)=0.50mol/L、c(H2)=1mol/L,浓度商=
| 1 |
| 0.50×11 |
故答案为:正反应;
③设n(H2)=amol、n(CO)=bmol,氢气的转化率为40%、CO的转化率为60%,根据方程式知,参加反应的n(CO)为参加反应的n(H2)的一半,所以40%amol=2bmol×60%,x=3,
故答案为:3;
(3)Fe3+完全沉淀时c(OH-)3=
| Ksp[Fe(OH)3] |
| 4×10-5 |
| 4×10-38 |
| 4×10-5 |
| Ksp[Cu(OH)2] |
| c(Cu2+) |
| 2.6×10-19 |
| 0.26 |
故答案为:3≤pH<5;
(4)Cu电极是阴极,阴极上电极反应式为2H2O+2e-=H2↑+2OH-,浓NaOH溶液中钠离子通过阳离子交换膜进入阴极室,所以阴极室溶液中溶质为NaOH;阳极上Fe失电子和OH-反应生成Na2FeO4,电极反应式为,
故答案为:NaOH; Fe-6e-+8OH-=FeO42-+4H2O.
看了 铁及其化合物在工农业生产中有...的网友还看了以下:
下列常用的工具中,属于省力机械的是(填序号)A.扫帚B.老虎钳C.钓鱼竿D.羊角锤E.剪铁皮的剪刀 2020-05-16 …
下列常用的工具中,属于省力机械的是(填序号)A.扫帚B.老虎钳C.钓鱼竿D.羊角锤E.剪铁皮的剪刀 2020-05-16 …
“颠簸”、“颠簸”英语怎么表达?汽车或列车行驶过程中的那种颠簸、摇晃应该怎么表达?e.g.地铁行驶 2020-05-22 …
(77~78题共用备选答案)A.大米B.动物肝C.豆腐D.牛乳E.蔬菜铁吸收率最低的食物是 2020-06-04 …
当病人输入大量库存血后容易出现A.低血钾B.低血钙C.低血钠D.高血钠E.高血铁 2020-06-07 …
31.匙状甲常见于A.慢性肺脓肿B.支气管肺癌C.支气管扩张D.肝硬化E.缺铁性贫血 2020-07-03 …
如图表示某些物质间转化关系.其中A、B、C、D是初中化学中常见的单质,常温下,甲是一种无色液体,乙 2020-07-22 …
航班为什么没有E座?求官方详细解释…………飞机座位为什么没有E座?高铁座位也没有…E这个字母有什么特 2020-11-07 …
下列常用的工具中,能省力的机械是.(填序号)A.扫地用的大扫帚B.钓鱼竿C.剪铁丝的老虎钳D.筷子E 2020-11-21 …
1、下列单位中,不属于词组的是().A、文化B、文人C、救人D、变化E、化铁2下列单位中,属于词组的 2020-11-26 …