早教吧作业答案频道 -->化学-->
某化学小组研究盐酸被氧化的条件,进行如下实验.(1)研究盐酸被MnO2氧化.实验操作现象I常温下将MnO2和12mol•L-1浓盐酸混合溶液呈浅棕色,略有刺激性气味II将
题目详情
某化学小组研究盐酸被氧化的条件,进行如下实验.
(1)研究盐酸被MnO2氧化.
①已知MnO2呈弱碱性. I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是___.
②II中发生了分解反应,反应的化学方程式是___.
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验(图1)IV进行探究:
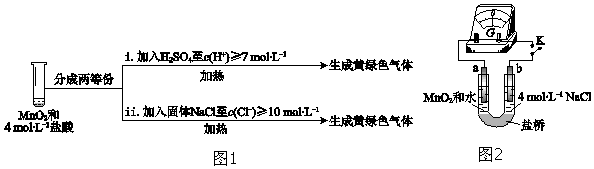
将实验 III、IV作对比,得出的结论是___;将 i、ii作对比,得出的结论是___.
④用图2装置(a、b均为石墨电极)进行实验 V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针向左偏转幅度增大
将ⅰ和ⅱ、ⅲ作对比,得出的结论是___.
(2)研究盐酸能否被氧化性酸氧化.
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸___(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2.
通过实验 I、II、III证明混合气体中含有Cl2,III的操作是___.
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、___有关.
(1)研究盐酸被MnO2氧化.
| 实验 | 操作 | 现象 |
| I | 常温下将MnO2和12mol•L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| II | 将 I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| III | 加热MnO2和4mol•L-1稀盐酸混合物 | 无明显现象 |
②II中发生了分解反应,反应的化学方程式是___.
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验(图1)IV进行探究:

将实验 III、IV作对比,得出的结论是___;将 i、ii作对比,得出的结论是___.
④用图2装置(a、b均为石墨电极)进行实验 V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针向左偏转幅度增大
将ⅰ和ⅱ、ⅲ作对比,得出的结论是___.
(2)研究盐酸能否被氧化性酸氧化.
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸___(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2.
| 实验 | 操作 | 现象 |
| I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
| II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
| III | … | … |
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、___有关.
▼优质解答
答案和解析
(1)①常温下将MnO2和12mol•L-1浓盐酸混合,溶液呈浅棕色,略有刺激性气味,已知MnO2呈弱碱性. I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,结合元素化合价不变书写化学方程式MnO2+4HCl═MnCl4+2H2O,
故答案为:MnO2+4HCl═MnCl4+2H2O;
②将 I中混合物过滤,加热滤液生成大量黄绿色气体为氯气,说明分解产物有氯气,锰元素化合价降低是氯化锰,反应的化学方程式为:MnCl4═Cl2↑+MnCl2 ,
故答案为:MnCl4═Cl2↑+MnCl2 ;
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,将实验 III、IV作对比,得出的结论是III中没有明显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被MnO2氧化,将 i、ii作对比,加热MnO2和4mol•L-1稀盐酸混合物,加入硫酸和加入氯化钠都生成黄绿色气体,其中氢离子浓度小于氯离子,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-),
故答案为:III中没有明显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被MnO2氧化;MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-);
④向右管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针偏转幅度变化不大说明氢离子浓度影响不大;再向左管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针向左偏转幅度增大
,说明氢离子浓度对二氧化锰影响大,将ⅰ和ⅱ、ⅲ作对比,得出的结论是HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强,
故答案为:HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强;
(2)①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象,无氯气生成,说明盐酸未被浓硫酸氧化,白雾为盐酸小液滴,
故答案为:不能;
②将湿润的淀粉KI试纸伸入棕黄色气体中试纸先变蓝,后褪色,将湿润的淀粉KI试纸伸入纯净Cl2中试纸先变蓝,后褪色,气体中含氯气、二氧化氮,通过实验 I、II、III证明混合气体中含有Cl2,操作Ⅲ是验证纯净二氧化氮中润的淀粉KI试纸变化,操作是将湿润的淀粉KI试纸伸入纯净的NO2中,
故答案为:将湿润的淀粉KI试纸伸入纯净的NO2中;
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、c(Cl-)、c(H+)浓度有关,
故答案为:c(Cl-)、c(H+);
故答案为:MnO2+4HCl═MnCl4+2H2O;
②将 I中混合物过滤,加热滤液生成大量黄绿色气体为氯气,说明分解产物有氯气,锰元素化合价降低是氯化锰,反应的化学方程式为:MnCl4═Cl2↑+MnCl2 ,
故答案为:MnCl4═Cl2↑+MnCl2 ;
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,将实验 III、IV作对比,得出的结论是III中没有明显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被MnO2氧化,将 i、ii作对比,加热MnO2和4mol•L-1稀盐酸混合物,加入硫酸和加入氯化钠都生成黄绿色气体,其中氢离子浓度小于氯离子,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-),
故答案为:III中没有明显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被MnO2氧化;MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-);
④向右管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针偏转幅度变化不大说明氢离子浓度影响不大;再向左管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针向左偏转幅度增大
,说明氢离子浓度对二氧化锰影响大,将ⅰ和ⅱ、ⅲ作对比,得出的结论是HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强,
故答案为:HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强;
(2)①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象,无氯气生成,说明盐酸未被浓硫酸氧化,白雾为盐酸小液滴,
故答案为:不能;
②将湿润的淀粉KI试纸伸入棕黄色气体中试纸先变蓝,后褪色,将湿润的淀粉KI试纸伸入纯净Cl2中试纸先变蓝,后褪色,气体中含氯气、二氧化氮,通过实验 I、II、III证明混合气体中含有Cl2,操作Ⅲ是验证纯净二氧化氮中润的淀粉KI试纸变化,操作是将湿润的淀粉KI试纸伸入纯净的NO2中,
故答案为:将湿润的淀粉KI试纸伸入纯净的NO2中;
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、c(Cl-)、c(H+)浓度有关,
故答案为:c(Cl-)、c(H+);
看了 某化学小组研究盐酸被氧化的条...的网友还看了以下:
氯水氧化I-是HClO是否能氧化I-氯水氧化I-“时” 2020-03-30 …
初中化学——实验室制取氧气实验室用过氧化氢溶液和二氧化锰制取氧气气体发生装置内总质量反映前 35. 2020-05-16 …
实验创新是中学生最为重要的科学素养,以下是化学兴趣小组的同学在学习“二氧化锰催化过氧化氢分解制氧气 2020-05-17 …
如图所示为实验室中常见的气体制备和收集装置.请回答下列问题:(1)实验室用过氧化氢溶液和二氧化锰制 2020-05-17 …
写出和配平红磷(白磷)在空气中燃烧加热汞加热氧化汞实验室用过氧化氢制氧气实验室用氯酸钾制氧气实验室 2020-05-24 …
如图所示为实验室中常见的气体制备和收集装置.请回答下列问题:(1)若用装置D收集氧气,验满的方法是 2020-06-25 …
某溶液中含有C1-和I-的物质的量浓度相同。为了氧化I-而不使C1-氧化,试根据下列三个反应判断可 2020-07-09 …
实验创新是中学生最为重要的科学素养,以下是化学兴趣小组的同学在学习“二氧化锰催化过氧化氢分解制氧气实 2020-11-14 …
HNO3能不能氧化I如果硝酸能氧化I离子,那么怎么解释:I离子检验中先加硝酸酸化,再加硝酸银,如果硝 2020-12-08 …
做下列物质在氧气中燃烧的实验之前,先要在集气瓶底放水或铺沙防止集气瓶炸裂的是()A.生成二氧化碳实验 2020-12-24 …