早教吧作业答案频道 -->化学-->
(1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.已知:N2(g)+2H2(g)═N2H4(l)△H=+50.6kJ•mol-1;2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1则①N2H4(l)+O2(g)═
题目详情
(1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.
已知:
N2(g)+2H2(g)═N2H4(l)△H=+50.6kJ•mol-1;
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则①N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=___kJ•mol-1
②N2(g)+2H2(g)═N2H4(l) 不能自发进行的原因是___.
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是___.
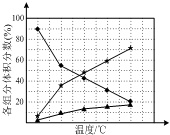
(2)在纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,则N2H4发生分解反应的化学方程式为___.
(3)N2H4与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的相对分子质量为43.0,其中氮原子的质量分数为0.977.该氢化物受撞击后可完全分解为两种单质气体.该氢化物分解的化学方程式为___.
(4)氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应方程式为6NO+4NH3═5N2十6H2O,6NO2+8NH3═7N2+12H2O.若尾气中NO和NO2共18mol被氨水完全吸收后,产生了15.6mol N2,则此尾气中NO与NO2的体积比为___.
 (1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.
(1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.
已知:
N2(g)+2H2(g)═N2H4(l)△H=+50.6kJ•mol-1;
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则①N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=___kJ•mol-1
②N2(g)+2H2(g)═N2H4(l) 不能自发进行的原因是___.
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是___.
(2)在纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,则N2H4发生分解反应的化学方程式为___.
(3)N2H4与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的相对分子质量为43.0,其中氮原子的质量分数为0.977.该氢化物受撞击后可完全分解为两种单质气体.该氢化物分解的化学方程式为___.
(4)氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应方程式为6NO+4NH3═5N2十6H2O,6NO2+8NH3═7N2+12H2O.若尾气中NO和NO2共18mol被氨水完全吸收后,产生了15.6mol N2,则此尾气中NO与NO2的体积比为___.
 24
24
2224-1
222-1
24222-1
2224
24
2424
24
23222322222

已知:
N2(g)+2H2(g)═N2H4(l)△H=+50.6kJ•mol-1;
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则①N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=___kJ•mol-1
②N2(g)+2H2(g)═N2H4(l) 不能自发进行的原因是___.
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是___.
(2)在纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,则N2H4发生分解反应的化学方程式为___.
(3)N2H4与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的相对分子质量为43.0,其中氮原子的质量分数为0.977.该氢化物受撞击后可完全分解为两种单质气体.该氢化物分解的化学方程式为___.
(4)氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应方程式为6NO+4NH3═5N2十6H2O,6NO2+8NH3═7N2+12H2O.若尾气中NO和NO2共18mol被氨水完全吸收后,产生了15.6mol N2,则此尾气中NO与NO2的体积比为___.
 (1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.
(1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.已知:
N2(g)+2H2(g)═N2H4(l)△H=+50.6kJ•mol-1;
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则①N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=___kJ•mol-1
②N2(g)+2H2(g)═N2H4(l) 不能自发进行的原因是___.
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是___.
(2)在纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,则N2H4发生分解反应的化学方程式为___.
(3)N2H4与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的相对分子质量为43.0,其中氮原子的质量分数为0.977.该氢化物受撞击后可完全分解为两种单质气体.该氢化物分解的化学方程式为___.
(4)氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应方程式为6NO+4NH3═5N2十6H2O,6NO2+8NH3═7N2+12H2O.若尾气中NO和NO2共18mol被氨水完全吸收后,产生了15.6mol N2,则此尾气中NO与NO2的体积比为___.
 24
242224-1
222-1
24222-1
2224
24
2424
24
23222322222

▼优质解答
答案和解析
(1)①a、N22(g)+2H22(g)═N22H44(l);△H=+50.6kJ•mol-1-1
b、2H22(g)+O22(g)═2H22O(l);△H=-571.6kJ•mol-1-1
依据盖斯定律b-a得到N22H44(l)+O22(g)═N22(g)+2H22O(l);△H=-622.2KJ/mol,
故答案为:-622.2;
②N22(g)+2H22(g)═N22H44(l)不能自发进行的原因是△H-T△S>0,则反应△S<0,△H>0,
故答案为:△H>0,△S<0;
③用次氯酸钠氧化氨气,可以得到N22H44的稀溶液,该反应的化学方程式为:NaClO+2NH33═N22H44+NaCl+H22O,
故答案为:NaClO+2NH33═N22H44+NaCl+H22O;
(2)使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒得知另外一种产物为氮气,故化学反应方程式为:3N22H44
N2+4NH3,
故答案为:3N2H4
N2+4NH3;
(3)氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氮氢原子个数比=
:
=3:1,所以该氢化物是N3H,N3H分解生成N2,H2;故分解方程为2HN3⇌3N2+H2,故答案为:2HN3⇌3N2+H2;
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
x+
y=15.6
解得:x:y=9:1,
故答案为:9:1.
△
催化剂 催化剂 催化剂 催化剂△ △ △N22+4NH33,
故答案为:3N22H44
N2+4NH3;
(3)氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氮氢原子个数比=
:
=3:1,所以该氢化物是N3H,N3H分解生成N2,H2;故分解方程为2HN3⇌3N2+H2,故答案为:2HN3⇌3N2+H2;
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
x+
y=15.6
解得:x:y=9:1,
故答案为:9:1.
△
催化剂 催化剂 催化剂 催化剂△ △ △N22+4NH33;
(3)氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氮氢原子个数比=
:
=3:1,所以该氢化物是N3H,N3H分解生成N2,H2;故分解方程为2HN3⇌3N2+H2,故答案为:2HN3⇌3N2+H2;
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
x+
y=15.6
解得:x:y=9:1,
故答案为:9:1.
43×0.977 14 43×0.977 43×0.977 43×0.97714 14 14:
=3:1,所以该氢化物是N3H,N3H分解生成N2,H2;故分解方程为2HN3⇌3N2+H2,故答案为:2HN3⇌3N2+H2;
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
x+
y=15.6
解得:x:y=9:1,
故答案为:9:1.
43×0.023 1 43×0.023 43×0.023 43×0.0231 1 1=3:1,所以该氢化物是N33H,N33H分解生成N22,H22;故分解方程为2HN33⇌3N22+H22,故答案为:2HN33⇌3N22+H22;
故答案为:2HN33═3N22+H22;
(4)设NO物质的量为xmol,NO22为ymol,根据化学方程式6NO+4NH33=5N22+6H22O;6NO22+8NH33=7N22+12H22O,列方程组,
x+y=18
x+
y=15.6
解得:x:y=9:1,
故答案为:9:1.
5 6 5 5 56 6 6x+
y=15.6
解得:x:y=9:1,
故答案为:9:1.
7 6 7 7 76 6 6y=15.6
解得:x:y=9:1,
故答案为:9:1.
b、2H22(g)+O22(g)═2H22O(l);△H=-571.6kJ•mol-1-1
依据盖斯定律b-a得到N22H44(l)+O22(g)═N22(g)+2H22O(l);△H=-622.2KJ/mol,
故答案为:-622.2;
②N22(g)+2H22(g)═N22H44(l)不能自发进行的原因是△H-T△S>0,则反应△S<0,△H>0,
故答案为:△H>0,△S<0;
③用次氯酸钠氧化氨气,可以得到N22H44的稀溶液,该反应的化学方程式为:NaClO+2NH33═N22H44+NaCl+H22O,
故答案为:NaClO+2NH33═N22H44+NaCl+H22O;
(2)使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒得知另外一种产物为氮气,故化学反应方程式为:3N22H44
| ||
| △ |
故答案为:3N2H4
| ||
| △ |
(3)氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氮氢原子个数比=
| 43×0.977 |
| 14 |
| 43×0.023 |
| 1 |
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
| 5 |
| 6 |
| 7 |
| 6 |
解得:x:y=9:1,
故答案为:9:1.
| ||
| △ |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
.
.
.
.
.故答案为:3N22H44
| ||
| △ |
(3)氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氮氢原子个数比=
| 43×0.977 |
| 14 |
| 43×0.023 |
| 1 |
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
| 5 |
| 6 |
| 7 |
| 6 |
解得:x:y=9:1,
故答案为:9:1.
| ||
| △ |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
.
.
.
.
.(3)氮的氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氮氢原子个数比=
| 43×0.977 |
| 14 |
| 43×0.023 |
| 1 |
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
| 5 |
| 6 |
| 7 |
| 6 |
解得:x:y=9:1,
故答案为:9:1.
| 43×0.977 |
| 14 |
| 43×0.023 |
| 1 |
故答案为:2HN3═3N2+H2;
(4)设NO物质的量为xmol,NO2为ymol,根据化学方程式6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,列方程组,
x+y=18
| 5 |
| 6 |
| 7 |
| 6 |
解得:x:y=9:1,
故答案为:9:1.
| 43×0.023 |
| 1 |
故答案为:2HN33═3N22+H22;
(4)设NO物质的量为xmol,NO22为ymol,根据化学方程式6NO+4NH33=5N22+6H22O;6NO22+8NH33=7N22+12H22O,列方程组,
x+y=18
| 5 |
| 6 |
| 7 |
| 6 |
解得:x:y=9:1,
故答案为:9:1.
| 5 |
| 6 |
| 7 |
| 6 |
解得:x:y=9:1,
故答案为:9:1.
| 7 |
| 6 |
解得:x:y=9:1,
故答案为:9:1.
看了 (1)联氨(N2H4)是一种...的网友还看了以下:
多肽和二肽二肽和多肽有什么关系?是氨基酸形成了二肽,二肽再形成多肽,还是氨基酸直接可以形成多肽?二 2020-04-25 …
硫酸铜中滴加氨水,除了生成配4个氨的铜离子之外,还能不能生成配有水和氨的铜的配合物? 2020-05-13 …
下列关于蛋白质和氨基酸的叙述,正确的是()A、具有生物催化作用的酶都是由氨基酸组成的B、高等动物能 2020-05-13 …
(2008•天津)下列关于蛋白质和氨基酸的叙述,正确的是()A.具有生物催化作用的酶都是由氨基酸组 2020-05-13 …
关于碱基决定氨基酸“若1个碱基决定一个氨基酸,则4种碱基只能决定4^1=4个氨基酸:若2个碱基决定 2020-05-17 …
为什么硫酸铜和氨形成络和物时要四个氨铜的价电子结构是,如果形成铜离子,其外围只有4s一个空轨道,不 2020-06-25 …
氨基酸的R基上是否氨基和羧基不能并存?R基上是否能存在多个氨基或羧基?如果是,一个氨基酸中是不是最 2020-06-26 …
苏氨酸—→丁酮酸+氨基,谷氨酸+丙酮酸—→酮戊二酸+丙氨酸,上述两个反应分别属于A.氨基转换作用和 2020-06-27 …
下列有关激素和氨基酸的叙述,正确的是()A.激素都是由氨基酸构成的B.生长素和胰岛素均能与双缩脲试 2020-07-05 …
古者天下散乱,莫之能一.和“奚以为知其然也?”宾语前置的条件是什么 2020-07-12 …