早教吧作业答案频道 -->化学-->
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:(1)用CH4催化还原NOx可以消除氮氧化物的污染.例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1CH4
题目详情
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若2mol CH4还原NO2至N2,整个过程中放出的热量为1734kJ,则△H2=___;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁.其反应如下:
Fe2O3(s)+3CH4(g)⇌2Fe(s)+3CO(g)+6H2(g)△H>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g.则
该段时间内CO的平均反应速率为___.
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是___(选填序号)
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
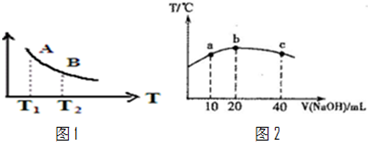
③该反应达到平衡时某物理量随温度变化如图1所示,当温度由T1升高到T2时,平衡常数KA___ KB(填“>”、“<”或“=”).纵坐标可以表示的物理量有哪些___.
a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
d.CO的体积分数
(3)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷
(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程
的总反应式为:N2+3H2
2NH3,该过程中还原反应的方程式为___.
(4)若往20mL 0.0lmol•L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图2所示,下列有关说法正确的是( )
①该烧碱溶液的浓度为0.02mol•L-1
②该烧碱溶液的浓度为0.01mol•L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
4x
42221-1
42222
4222
23
2342
23
4
2
12AB

2
4
+
22
2NH3,该过程中还原反应的方程式为___.
(4)若往20mL 0.0lmol•L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图2所示,下列有关说法正确的是( )
①该烧碱溶液的浓度为0.02mol•L-1
②该烧碱溶液的浓度为0.01mol•L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
一定条件 一定条件 一定条件 3
-l2
-1
-1
2
+2--+
(1)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若2mol CH4还原NO2至N2,整个过程中放出的热量为1734kJ,则△H2=___;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁.其反应如下:
Fe2O3(s)+3CH4(g)⇌2Fe(s)+3CO(g)+6H2(g)△H>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g.则
该段时间内CO的平均反应速率为___.
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是___(选填序号)
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图1所示,当温度由T1升高到T2时,平衡常数KA___ KB(填“>”、“<”或“=”).纵坐标可以表示的物理量有哪些___.

a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
d.CO的体积分数
(3)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷
(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程
的总反应式为:N2+3H2
| 一定条件 |
| |
(4)若往20mL 0.0lmol•L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图2所示,下列有关说法正确的是( )
①该烧碱溶液的浓度为0.02mol•L-1
②该烧碱溶液的浓度为0.01mol•L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
4x
42221-1
42222
4222
23
2342
23
4
2
12AB

2
4
+
22
| 一定条件 |
| |
(4)若往20mL 0.0lmol•L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图2所示,下列有关说法正确的是( )
①该烧碱溶液的浓度为0.02mol•L-1
②该烧碱溶液的浓度为0.01mol•L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
| 一定条件 |
| |
-l2
-1
-1
2
+2--+
▼优质解答
答案和解析
(1)CH44(g)+4NO22(g)=4NO(g)+CO22(g)+2H22O(g)△H11=-574kJ•mol-1-1 ①
CH44(g)+4NO(g)=2N22(g)+CO22(g)+2H22O(g)△H22 ②
根据盖斯定律得:2CH44(g)+4NO22(g)=2CO22(g)+4H22O(g)+2N22(g)△H11+△H22
而 1mol CH44还原NO22至N22,整个过程中放出的热量为867kJ,所以△H11+△H22=-1734kJ•mol-1-1,则△H22=-1734kJ•mol-1-1+574kJ•mol-1-1=-1160 kJ•mol-1-1,
故答案为:-1160kJ•mol-1-1;
(2)①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe22O33在反应中质量减少3.2g的物质的量=
=0.02mol,结合化学方程式,Fe2O3(s)+3CH4(g)═2Fe(s)+3CO(g)+6H2(g),计算反应的甲烷物质的量为0.06mol,则该段时间内CH4的平均反应速率=
=0.012mol/(L•min);
故答案为:0.012mol/(L•min);
②a.CH4的转化率与CO的产率与是否达到平衡状态无关,故a错误;
b.反应前后气体的物质的量和质量都不同,所以混合气体的平均相对分子质量不变说明反应达到平衡状态,故b正确;
c、v(CO)与v(H2)的比值始终不变,所以其不能说明反应达到平衡状态,故c错误;
d、固体的总质量不变,说明正逆反应速率相等,反应达到平衡状态,故d正确;
故答案为:bd;
③Fe2O3(s)+3CH4(g)═2Fe(s)+3CO(g)+6H2(g)△H>0,反应是气体体积增大的吸热反应,升温平衡正向移动,平衡常数增大,KA<KB;
a.H2的逆反应速率随温度的升高而增大,故a错误;
b.升温平衡正向移动,CH4的体积分数减小,故b正确;
c.升温平衡正向移动,混合气体的平均相对分子质量减小,故c正确;
d.升温平衡正向移动,CO的体积分数增大,故d错误;
故答案为:<;bc;
(3)阴极得电子发生还原反应:N2+6H++6e-=2NH3,故答案为:N2+6H++6e-=2NH3;
(4)①HNO2是弱酸,次氯酸电离是吸热反应,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,c(NaOH)=
=0.01mol/L;
故①错误,②正确;
③电离吸热,温度越高电离平衡常数越大,所以HNO2的电离平衡常数:b点>a点,故③正确;
④从b点到c点,当C(NaOH)较大时,可能出现:c(Na+)>c(OH-)>c(NO2-)>c(H+),故错误;
故答案为:②③.
3.2g 160g/mol 3.2g 3.2g 3.2g160g/mol 160g/mol 160g/mol=0.02mol,结合化学方程式,Fe22O33(s)+3CH44(g)═2Fe(s)+3CO(g)+6H22(g),计算反应的甲烷物质的量为0.06mol,则该段时间内CH44的平均反应速率=
=0.012mol/(L•min);
故答案为:0.012mol/(L•min);
②a.CH4的转化率与CO的产率与是否达到平衡状态无关,故a错误;
b.反应前后气体的物质的量和质量都不同,所以混合气体的平均相对分子质量不变说明反应达到平衡状态,故b正确;
c、v(CO)与v(H2)的比值始终不变,所以其不能说明反应达到平衡状态,故c错误;
d、固体的总质量不变,说明正逆反应速率相等,反应达到平衡状态,故d正确;
故答案为:bd;
③Fe2O3(s)+3CH4(g)═2Fe(s)+3CO(g)+6H2(g)△H>0,反应是气体体积增大的吸热反应,升温平衡正向移动,平衡常数增大,KA<KB;
a.H2的逆反应速率随温度的升高而增大,故a错误;
b.升温平衡正向移动,CH4的体积分数减小,故b正确;
c.升温平衡正向移动,混合气体的平均相对分子质量减小,故c正确;
d.升温平衡正向移动,CO的体积分数增大,故d错误;
故答案为:<;bc;
(3)阴极得电子发生还原反应:N2+6H++6e-=2NH3,故答案为:N2+6H++6e-=2NH3;
(4)①HNO2是弱酸,次氯酸电离是吸热反应,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,c(NaOH)=
=0.01mol/L;
故①错误,②正确;
③电离吸热,温度越高电离平衡常数越大,所以HNO2的电离平衡常数:b点>a点,故③正确;
④从b点到c点,当C(NaOH)较大时,可能出现:c(Na+)>c(OH-)>c(NO2-)>c(H+),故错误;
故答案为:②③.
1min
0.06mol 5L 0.06mol 0.06mol 0.06mol5L 5L 5L1min 1min 1min=0.012mol/(L•min);
故答案为:0.012mol/(L•min);
②a.CH44的转化率与CO的产率与是否达到平衡状态无关,故a错误;
b.反应前后气体的物质的量和质量都不同,所以混合气体的平均相对分子质量不变说明反应达到平衡状态,故b正确;
c、v(CO)与v(H22)的比值始终不变,所以其不能说明反应达到平衡状态,故c错误;
d、固体的总质量不变,说明正逆反应速率相等,反应达到平衡状态,故d正确;
故答案为:bd;
③Fe22O33(s)+3CH44(g)═2Fe(s)+3CO(g)+6H22(g)△H>0,反应是气体体积增大的吸热反应,升温平衡正向移动,平衡常数增大,KAABB;
a.H22的逆反应速率随温度的升高而增大,故a错误;
b.升温平衡正向移动,CH44的体积分数减小,故b正确;
c.升温平衡正向移动,混合气体的平均相对分子质量减小,故c正确;
d.升温平衡正向移动,CO的体积分数增大,故d错误;
故答案为:<;bc;
(3)阴极得电子发生还原反应:N22+6H+++6e--=2NH33,故答案为:N22+6H+++6e--=2NH33;
(4)①HNO22是弱酸,次氯酸电离是吸热反应,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,c(NaOH)=
=0.01mol/L;
故①错误,②正确;
③电离吸热,温度越高电离平衡常数越大,所以HNO2的电离平衡常数:b点>a点,故③正确;
④从b点到c点,当C(NaOH)较大时,可能出现:c(Na+)>c(OH-)>c(NO2-)>c(H+),故错误;
故答案为:②③.
0.020L×0.01mol/L 0.020L 0.020L×0.01mol/L 0.020L×0.01mol/L 0.020L×0.01mol/L0.020L 0.020L 0.020L=0.01mol/L;
故①错误,②正确;
③电离吸热,温度越高电离平衡常数越大,所以HNO22的电离平衡常数:b点>a点,故③正确;
④从b点到c点,当C(NaOH)较大时,可能出现:c(Na++)>c(OH--)>c(NO22--)>c(H++),故错误;
故答案为:②③.
CH44(g)+4NO(g)=2N22(g)+CO22(g)+2H22O(g)△H22 ②
根据盖斯定律得:2CH44(g)+4NO22(g)=2CO22(g)+4H22O(g)+2N22(g)△H11+△H22
而 1mol CH44还原NO22至N22,整个过程中放出的热量为867kJ,所以△H11+△H22=-1734kJ•mol-1-1,则△H22=-1734kJ•mol-1-1+574kJ•mol-1-1=-1160 kJ•mol-1-1,
故答案为:-1160kJ•mol-1-1;
(2)①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe22O33在反应中质量减少3.2g的物质的量=
| 3.2g |
| 160g/mol |
| ||
| 1min |
故答案为:0.012mol/(L•min);
②a.CH4的转化率与CO的产率与是否达到平衡状态无关,故a错误;
b.反应前后气体的物质的量和质量都不同,所以混合气体的平均相对分子质量不变说明反应达到平衡状态,故b正确;
c、v(CO)与v(H2)的比值始终不变,所以其不能说明反应达到平衡状态,故c错误;
d、固体的总质量不变,说明正逆反应速率相等,反应达到平衡状态,故d正确;
故答案为:bd;
③Fe2O3(s)+3CH4(g)═2Fe(s)+3CO(g)+6H2(g)△H>0,反应是气体体积增大的吸热反应,升温平衡正向移动,平衡常数增大,KA<KB;
a.H2的逆反应速率随温度的升高而增大,故a错误;
b.升温平衡正向移动,CH4的体积分数减小,故b正确;
c.升温平衡正向移动,混合气体的平均相对分子质量减小,故c正确;
d.升温平衡正向移动,CO的体积分数增大,故d错误;
故答案为:<;bc;
(3)阴极得电子发生还原反应:N2+6H++6e-=2NH3,故答案为:N2+6H++6e-=2NH3;
(4)①HNO2是弱酸,次氯酸电离是吸热反应,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,c(NaOH)=
| 0.020L×0.01mol/L |
| 0.020L |
故①错误,②正确;
③电离吸热,温度越高电离平衡常数越大,所以HNO2的电离平衡常数:b点>a点,故③正确;
④从b点到c点,当C(NaOH)较大时,可能出现:c(Na+)>c(OH-)>c(NO2-)>c(H+),故错误;
故答案为:②③.
| 3.2g |
| 160g/mol |
| ||
| 1min |
故答案为:0.012mol/(L•min);
②a.CH4的转化率与CO的产率与是否达到平衡状态无关,故a错误;
b.反应前后气体的物质的量和质量都不同,所以混合气体的平均相对分子质量不变说明反应达到平衡状态,故b正确;
c、v(CO)与v(H2)的比值始终不变,所以其不能说明反应达到平衡状态,故c错误;
d、固体的总质量不变,说明正逆反应速率相等,反应达到平衡状态,故d正确;
故答案为:bd;
③Fe2O3(s)+3CH4(g)═2Fe(s)+3CO(g)+6H2(g)△H>0,反应是气体体积增大的吸热反应,升温平衡正向移动,平衡常数增大,KA<KB;
a.H2的逆反应速率随温度的升高而增大,故a错误;
b.升温平衡正向移动,CH4的体积分数减小,故b正确;
c.升温平衡正向移动,混合气体的平均相对分子质量减小,故c正确;
d.升温平衡正向移动,CO的体积分数增大,故d错误;
故答案为:<;bc;
(3)阴极得电子发生还原反应:N2+6H++6e-=2NH3,故答案为:N2+6H++6e-=2NH3;
(4)①HNO2是弱酸,次氯酸电离是吸热反应,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,c(NaOH)=
| 0.020L×0.01mol/L |
| 0.020L |
故①错误,②正确;
③电离吸热,温度越高电离平衡常数越大,所以HNO2的电离平衡常数:b点>a点,故③正确;
④从b点到c点,当C(NaOH)较大时,可能出现:c(Na+)>c(OH-)>c(NO2-)>c(H+),故错误;
故答案为:②③.
| ||
| 1min |
| 0.06mol |
| 5L |
| 0.06mol |
| 5L |
| 0.06mol |
| 5L |
| 0.06mol |
| 5L |
故答案为:0.012mol/(L•min);
②a.CH44的转化率与CO的产率与是否达到平衡状态无关,故a错误;
b.反应前后气体的物质的量和质量都不同,所以混合气体的平均相对分子质量不变说明反应达到平衡状态,故b正确;
c、v(CO)与v(H22)的比值始终不变,所以其不能说明反应达到平衡状态,故c错误;
d、固体的总质量不变,说明正逆反应速率相等,反应达到平衡状态,故d正确;
故答案为:bd;
③Fe22O33(s)+3CH44(g)═2Fe(s)+3CO(g)+6H22(g)△H>0,反应是气体体积增大的吸热反应,升温平衡正向移动,平衡常数增大,KAA
a.H22的逆反应速率随温度的升高而增大,故a错误;
b.升温平衡正向移动,CH44的体积分数减小,故b正确;
c.升温平衡正向移动,混合气体的平均相对分子质量减小,故c正确;
d.升温平衡正向移动,CO的体积分数增大,故d错误;
故答案为:<;bc;
(3)阴极得电子发生还原反应:N22+6H+++6e--=2NH33,故答案为:N22+6H+++6e--=2NH33;
(4)①HNO22是弱酸,次氯酸电离是吸热反应,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,c(NaOH)=
| 0.020L×0.01mol/L |
| 0.020L |
故①错误,②正确;
③电离吸热,温度越高电离平衡常数越大,所以HNO2的电离平衡常数:b点>a点,故③正确;
④从b点到c点,当C(NaOH)较大时,可能出现:c(Na+)>c(OH-)>c(NO2-)>c(H+),故错误;
故答案为:②③.
| 0.020L×0.01mol/L |
| 0.020L |
故①错误,②正确;
③电离吸热,温度越高电离平衡常数越大,所以HNO22的电离平衡常数:b点>a点,故③正确;
④从b点到c点,当C(NaOH)较大时,可能出现:c(Na++)>c(OH--)>c(NO22--)>c(H++),故错误;
故答案为:②③.
看了 碳、氮及其化合物在工农业生产...的网友还看了以下:
Excel中相同的产品,不同价格,不同数量,怎么求和?例如产品 数量 价格a 2 6b 3 5c 2020-05-16 …
【1】加法交换律 用数举例 用字母表示【2】加法结合律 用数举例 用字母表示【3】乘法交换律 用数 2020-05-16 …
当间接成本在产品成本中所占比例较大时,采用产量基础成本计算制度可能导致的结果有( )。A.夸大 2020-05-19 …
在各种不同的软件需求中,(16)描述了用户使用产品必须要完成的任务,可以在用例模型中予以说明。A. 2020-05-26 …
某企业生产甲·乙两种产品,共耗用A材料200千克,每千克400元.甲产品的重量为3000千克,乙产 2020-07-16 …
在excel中绘制双坐标轴图(柱形图和折线图)产品A产品B产品C产品D产品价格1202253304 2020-07-30 …
孟德尔的两对相对性状的杂交实验中,具有1:1:1:1比例的是()①F1测交后代性状表现的比例②F1产 2020-11-02 …
随机产生一个3位正整数,然后逆序输出,产生的随机数与逆序数同时显示,例如产生198,逆序981.用v 2020-11-28 …
孟德尔的一对相对性状杂交实验中,符合1:1的有()①F1测交后代表现型比例②F1自交后代基因型比例③ 2020-11-28 …
信息技术在各个领域的应用信息技术在日常学习、通信服务、金融和商业、医疗保健、工业生产、科学技术这6个 2020-12-05 …