早教吧作业答案频道 -->化学-->
50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻
题目详情
50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题:
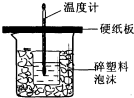
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___;
(2)烧杯间填满碎塑料泡沫的作用是___.
(3)大烧杯上如不盖硬纸板,则求得的反应热数值___(填“偏大”、“偏小’、“无影响”).
(4)若实验过程中,测得盐酸和NaOH溶液的起始温度的平均值为25.2℃.溶液混合后的最高温度为28.6℃.试经过计算写出表示该反应中和热和热化学方程式:___
(混合溶液的比热容c=4.18J/(g℃),盐酸和NaOH溶液的密度认为都是1g/cm-3假设混合前压器后溶液的体积不变,热值的计算结果保留一位小数)
(5)用相同浓度和体积的浓硫酸代替盐酸溶液进行上述实验,测得中和热的数值会___(填“偏大”、“偏小”、“无影响”).

-3

(1)从实验装置上看,图中尚缺少的一种玻璃用品是___;
(2)烧杯间填满碎塑料泡沫的作用是___.
(3)大烧杯上如不盖硬纸板,则求得的反应热数值___(填“偏大”、“偏小’、“无影响”).
(4)若实验过程中,测得盐酸和NaOH溶液的起始温度的平均值为25.2℃.溶液混合后的最高温度为28.6℃.试经过计算写出表示该反应中和热和热化学方程式:___
(混合溶液的比热容c=4.18J/(g℃),盐酸和NaOH溶液的密度认为都是1g/cm-3假设混合前压器后溶液的体积不变,热值的计算结果保留一位小数)
(5)用相同浓度和体积的浓硫酸代替盐酸溶液进行上述实验,测得中和热的数值会___(填“偏大”、“偏小”、“无影响”).

-3
▼优质解答
答案和解析
(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;
故答案为:减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小;
故答案为:偏小;
(4)平均温度差为3.4℃,50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100g,温度变化的值为3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
=-56.8kJ/mol,该反应中和热和热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8kJ/mol;
(5)浓硫酸稀释时放热,所以用浓硫酸代替盐酸溶液进行上述实验,反应放出的热量偏大,测得中和热的数值会偏大,故答案为:偏大.
1.4212kJ 0.025mol 1.4212kJ 1.4212kJ 1.4212kJ0.025mol 0.025mol 0.025mol=-56.8kJ/mol,该反应中和热和热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H22O(l)△H=-56.8kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H22O(l)△H=-56.8kJ/mol;
(5)浓硫酸稀释时放热,所以用浓硫酸代替盐酸溶液进行上述实验,反应放出的热量偏大,测得中和热的数值会偏大,故答案为:偏大.
故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;
故答案为:减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小;
故答案为:偏小;
(4)平均温度差为3.4℃,50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100g,温度变化的值为3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
| 1.4212kJ |
| 0.025mol |
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8kJ/mol;
(5)浓硫酸稀释时放热,所以用浓硫酸代替盐酸溶液进行上述实验,反应放出的热量偏大,测得中和热的数值会偏大,故答案为:偏大.
| 1.4212kJ |
| 0.025mol |
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H22O(l)△H=-56.8kJ/mol;
(5)浓硫酸稀释时放热,所以用浓硫酸代替盐酸溶液进行上述实验,反应放出的热量偏大,测得中和热的数值会偏大,故答案为:偏大.
看了 50mL0.5mol/L的盐...的网友还看了以下:
关于sp2sp3杂化的问题(一)比如NO2-分子中心N应该是6电子采取sp2杂化那应该是(1)N给每 2020-03-30 …
一个高一的化学问题1.请你估计,O(质量数为16),H(质量数为1),H(质量数为2)三种核素最多 2020-05-13 …
血红素中含有C、O、N、Fe五种元素.回答下列问题:(1)C、N、O、H四种元素中电负性最小的是( 2020-05-14 …
大学物理实验思考题答案(用光电效应测普朗克常量):(同志们,请简答下列问题!)^o^~1,光电效应 2020-05-15 …
A.O(n2)和O(1)B.O(nlog2n)和O(1)C.O(nlog2n)和O(n)D.O(n2 2020-05-26 …
(接上一题)则时间和空间复杂度分别为(63)。A.O(n2)和O(n)B.O(nlgn)和O(n)C 2020-05-26 …
(63)A.O(n2)和O(n)B.O(nlgn)和O(n)C.O(n2)和O(1)D.O(nlgn 2020-05-26 …
26.将一副三角板中的含有60°角的三角板的顶点和另一块的45°角的顶点重合于一点O,绕着点O旋转 2020-06-02 …
A/O排泥问题:arm:A/O后面有个沉淀池.排泥是只排沉淀池的泥么?如果是这样,想保证A/O的泥 2020-07-07 …
某物质含有某种原子,这种说法对吗?如果对,那么这道题选什么?理论来说是单选题啊?1,MnO2,CO 2020-07-21 …