早教吧作业答案频道 -->化学-->
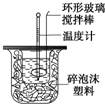
利用如图装置测定中和热的实验步骤如下:①用量筒量取50mL0.5mol/L盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL0.6mol/LNaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入
题目详情
利用如图装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.5mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL 0.6mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):___.
(2)倒入NaOH溶液的正确操作是___(从下列选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是___(从下列选出).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
②近似认为0.6mol/L NaOH溶液和0.6mol/L盐酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=___( 取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)___.
a.实验装置保温、隔热效果差
b.将盐酸转移至小烧杯时洒了一部分在外面
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度.

温度
实验次数 起始温度t1℃ 终止温度t2/℃ 温度差平均值 HCl NaOH 平均值 (t2-t1)/℃ 1 26.2 26.0 26.1 29.5 2 27.0 27.4 27.2 33.3 3 25.9 25.9 25.9 29.2 4 26.4 26.2 26.3 29.8 温度
实验次数 起始温度t1℃ 终止温度t2/℃ 温度差平均值 温度
实验次数
起始温度t1℃ 1终止温度t2/℃ 2温度差平均值 HCl NaOH 平均值 (t2-t1)/℃ HCl NaOH 平均值 (t2-t1)/℃ 21 1 26.2 26.0 26.1 29.5 1 26.2 26.0 26.1 29.5 2 27.0 27.4 27.2 33.3 2 27.0 27.4 27.2 33.3 3 25.9 25.9 25.9 29.2 3 25.9 25.9 25.9 29.2 4 26.4 26.2 26.3 29.8 4 26.4 26.2 26.3 29.8 3
①用量筒量取50mL 0.5mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL 0.6mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:

(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):___.
(2)倒入NaOH溶液的正确操作是___(从下列选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是___(从下列选出).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 | ||
| HCl | NaOH | 平均值 | (t2-t1)/℃ | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)___.
a.实验装置保温、隔热效果差
b.将盐酸转移至小烧杯时洒了一部分在外面
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度.

| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 | ||
| HCl | NaOH | 平均值 | (t2-t1)/℃ | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
实验次数
实验次数
实验次数
▼优质解答
答案和解析
(1)强酸强碱的中和热为-57.3kJ/mol,即强酸和强碱的稀溶液完全反应生成1mol水放出的热量为57.3kJ,稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:HCl (aq)+NaOH(aq)=NaCl(aq)+H22O(l)△H=-57.3 kJ/mol;
故答案为:HCl (aq)+NaOH(aq)=NaCl(aq)+H22O(l)△H=-57.3 kJ/mol;
(2)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
故选:C;
(3)使盐酸与NaOH溶液混合均匀的正确操作是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;温度计是测量温度的,不能使用温度计搅拌;也不能轻轻地振荡烧杯,否则可能导致液体溅出或热量散失,影响测定结果;更不能打开硬纸片用玻璃棒搅拌,否则会有热量散失;
故选:D;
(4)①4次温度差分别为:3.4℃,6.1℃,3.3℃,3.5℃,第2组数据无效,其他三次温度差平均值为3.4℃,故答案为:3.4℃;
②50mL 0.5mol/L盐酸与50mL 0.6mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.5mol/L=0.025mol,溶液的质量为100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212kJ,所以实验测得的中和热△H=-
=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.将盐酸转移至小烧杯时洒了一部分在外面,放出的热量偏小,中和热的数值偏小,故b正确;
c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏小,中和热的数值偏小,故c正确;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度,盐酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确;
故选:abcd.
1.4212kJ 0.025mol 1.4212kJ 1.4212kJ 1.4212kJ0.025mol 0.025mol 0.025mol=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.将盐酸转移至小烧杯时洒了一部分在外面,放出的热量偏小,中和热的数值偏小,故b正确;
c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏小,中和热的数值偏小,故c正确;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度,盐酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确;
故选:abcd.
故答案为:HCl (aq)+NaOH(aq)=NaCl(aq)+H22O(l)△H=-57.3 kJ/mol;
(2)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
故选:C;
(3)使盐酸与NaOH溶液混合均匀的正确操作是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;温度计是测量温度的,不能使用温度计搅拌;也不能轻轻地振荡烧杯,否则可能导致液体溅出或热量散失,影响测定结果;更不能打开硬纸片用玻璃棒搅拌,否则会有热量散失;
故选:D;
(4)①4次温度差分别为:3.4℃,6.1℃,3.3℃,3.5℃,第2组数据无效,其他三次温度差平均值为3.4℃,故答案为:3.4℃;
②50mL 0.5mol/L盐酸与50mL 0.6mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.5mol/L=0.025mol,溶液的质量为100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212kJ,所以实验测得的中和热△H=-
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.将盐酸转移至小烧杯时洒了一部分在外面,放出的热量偏小,中和热的数值偏小,故b正确;
c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏小,中和热的数值偏小,故c正确;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度,盐酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确;
故选:abcd.
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.将盐酸转移至小烧杯时洒了一部分在外面,放出的热量偏小,中和热的数值偏小,故b正确;
c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏小,中和热的数值偏小,故c正确;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度,盐酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确;
故选:abcd.
看了 利用如图装置测定中和热的实验...的网友还看了以下:
5、在甲烧杯中放入盐酸,乙烧杯中放入某一元酸HA,两种溶液的体积和pH都相等,向两烧杯中同时加入质 2020-05-23 …
实验室欲制备FeCl3固体.已知FeCl3固体易吸水潮解.现利用如图装置制取FeCl3固体.(1) 2020-06-27 …
某烧杯中盛有溶质质量分数为20%的盐酸,向烧杯中放入10.Og石灰石样品(所含杂质不溶于水和酸,也 2020-07-12 …
为了测定某石灰石中碳酸钙的质量分数.取石灰石样品,与足量质量分数为7.3%的稀盐酸在烧杯(烧杯质量 2020-07-25 …
小明同学在实验室称取了26g锌,放在盛有足量稀盐酸的烧杯中进行充分反应,试计算反应共生成氢气多少克 2020-07-25 …
浓硫酸、烧碱是实验室中常用的试剂.(1)浓硫酸可以做干燥剂,是利用了浓硫酸的什么性质?(2)实验室有 2020-11-06 …
在化学上什么叫清洗怎样叫清洗6.某学生做完实验后,采用下列方法清洗仪器①用酒精清洗做过碘升华实验的烧 2020-11-10 …
(2014•开封一模)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe 2020-11-12 …
(2014•枣庄)为了测定某纯碱样品中碳酸钠的质量分数,取该样品与足量稀盐酸在烧杯中反应,有关实验数 2020-11-13 …
(2014•济南)正确的实验操作是进行科学实验的重要保障.下列操作中,合理的是()A.少量酒精在实验 2021-01-14 …