早教吧作业答案频道 -->化学-->
利用如图1装置测定中和热的实验步骤如下:①用量筒量取50mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;②用另一量筒量取50mL0.55mol/LNaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入
题目详情
利用如图1装置测定中和热的实验步骤如下:
①用量筒量取50mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol/LNaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
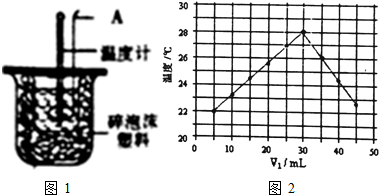
(1)仪器A的名称为___.
(2)写成稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol)___.
(3)倒入NaOH溶液的正确操作是___(填序号).
A.沿玻璃棒缓慢倒入B.分三次少量倒入C.一次迅速倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是E(从下列选出)___.
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(5)实验数据如下表:
①请填写下表中的空白:
②近似认为0.55mol/LNaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=___(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(6)将V1mL1.0mol/LHCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL).则NaOH溶液的物质的量浓度为___.

温度
实验次数 起始温度t1℃ 终止温度t2℃ 温度差平均值(t2-t1)℃ H2SO4 NaOH 平均值 1 26.2 26.0 26.1 29.5 2 27.0 27.4 27.2 32.3 3 25.9 25.9 25.9 29.2 4 26.4 26.2 26.3 29.8 温度
实验次数 起始温度t1℃ 终止温度t2℃ 温度差平均值(t2-t1)℃ 温度
实验次数
起始温度t1℃ 1终止温度t2℃ 2温度差平均值(t2-t1)℃ 21 H2SO4 NaOH 平均值 H2SO4 24NaOH 平均值 1 26.2 26.0 26.1 29.5 1 26.2 26.0 26.1 29.5 2 27.0 27.4 27.2 32.3 2 27.0 27.4 27.2 32.3 3 25.9 25.9 25.9 29.2 3 25.9 25.9 25.9 29.2 4 26.4 26.2 26.3 29.8 4 26.4 26.2 26.3 29.8 3
24
1212
①用量筒量取50mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol/LNaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:

(1)仪器A的名称为___.
(2)写成稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol)___.
(3)倒入NaOH溶液的正确操作是___(填序号).
A.沿玻璃棒缓慢倒入B.分三次少量倒入C.一次迅速倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是E(从下列选出)___.
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(5)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | 温度差平均值(t2-t1)℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(6)将V1mL1.0mol/LHCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图2所示(实验中始终保持V1+V2=50mL).则NaOH溶液的物质的量浓度为___.

| 温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | 温度差平均值(t2-t1)℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
实验次数
实验次数
实验次数
24
1212
▼优质解答
答案和解析
(1)仪器A的名称为环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)强酸强碱的中和热为-57.3kJ/mol,中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,稀硫酸和稀氢氧化钠溶液反应的热化学方程式为:
H2SO4(l)+NaOH(l)=
Na2SO4(l)+H2O(l)△H=-57.3KJ/mol;
故答案为:
H2SO4(l)+NaOH(l)=
Na2SO4(l)+H2O(l)△H=-57.3KJ/mol;
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
1 2 1 1 12 2 2H22SO44(l)+NaOH(l)=
Na2SO4(l)+H2O(l)△H=-57.3KJ/mol;
故答案为:
H2SO4(l)+NaOH(l)=
Na2SO4(l)+H2O(l)△H=-57.3KJ/mol;
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
1 2 1 1 12 2 2Na22SO44(l)+H22O(l)△H=-57.3KJ/mol;
故答案为:
H2SO4(l)+NaOH(l)=
Na2SO4(l)+H2O(l)△H=-57.3KJ/mol;
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
1 2 1 1 12 2 2H22SO44(l)+NaOH(l)=
Na2SO4(l)+H2O(l)△H=-57.3KJ/mol;
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
1 2 1 1 12 2 2Na22SO44(l)+H22O(l)△H=-57.3KJ/mol;
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
1.4212kJ 0.025mol 1.4212kJ 1.4212kJ 1.4212kJ0.025mol 0.025mol 0.025mol=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H22SO44测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V11为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V11+V22=50mL,所以V22为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1-1;
故答案为:1.5 mol•L-1-1.
(2)强酸强碱的中和热为-57.3kJ/mol,中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,稀硫酸和稀氢氧化钠溶液反应的热化学方程式为:
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
| 1 |
| 2 |
| 1 |
| 2 |
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
| 1 |
| 2 |
(3)根据硫酸和氢氧化钠反应反应迅速剧烈,并且释放大量热,一次性快速倒入可以减少热量散发而引来的误差,故选:C;
(4)用套在温度计上的环形玻璃棒轻轻地搅动使硫酸与NaOH溶液混合均匀,故选:D.
(5)①4次温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,第2组数据无效,温度差平均值为3.4℃,故答案为:3.4℃;
②50mL0.25mol/L硫酸与50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1;
故答案为:1.5 mol•L-1.
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H22SO44测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd;
(6)如图,V11为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V11+V22=50mL,所以V22为20mL,由酸碱中和关系式:NaOH~HCl可列式:30mL×1mol•L-1-1=20mL×C(NaOH),可求NaOH的浓度是1.5 mol•L-1-1;
故答案为:1.5 mol•L-1-1.
看了 利用如图1装置测定中和热的实...的网友还看了以下:
下列有关实验装置及用途叙述完全正确的是A.a装置检验消去产物,中间应加水洗装置B.b装置检验酸性: 2020-04-08 …
小明用如图所示装置验证酸碱中和反应,试回答:(1)用胶头滴管吸取盐酸逐滴加入烧杯中,当溶液刚好由色 2020-05-14 …
某同学在实验室进行有关浓硫酸的实验,观察瓶上的标签如下所示.他从瓶中倒出200毫升用于配置稀硫酸. 2020-05-16 …
这是倒置吗?倒置的定义是什么?Itwasnotuntilshearrivedintheclassr 2020-06-03 …
请问用高碘酸钠(AR,分析纯)如何配置2.14%(g/mL)的高碘酸钠溶液?还有“50%乙二醇”和 2020-06-21 …
下列行为中,符合安全要求的是()A.节日期间,在任意场所燃放烟花爆竹B.实验时,将水倒入浓硫酸配置 2020-06-27 …
配置稀盐酸浓度为36的浓盐酸 配置成3%的稀盐酸500ML 应该加多少水和多少盐酸 弄硫酸配置为4 2020-06-27 …
探究种子萌发的环境条件.实验步骤如下:瓶号处置①放倒罐头瓶,放两张餐巾纸②在餐巾纸上撒一些种子③放 2020-07-12 …
探究种子萌发的环境条件.实验步骤如下:瓶号处置①放倒罐头瓶,放两张餐巾纸②在餐巾纸上撒一些种子③放 2020-07-18 …
求实验装置图乙酸乙酯的水解乙酸乙酯的水解的装置图和具体实验步骤 2021-01-24 …