早教吧作业答案频道 -->化学-->
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物能使湿润的红色石蕊试纸变蓝;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物
题目详情
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物能使湿润的红色石蕊试纸变蓝;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)G元素在周期表中的位置是___.
(2)A与B可组成质量比为7:16的三原子分子,该分子与水反应的化学方程式:___;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH___7(填“>“或“<”或“=”),若所得溶液的pH=7,则a___b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:___.
(5)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g)与E(s)反应生成EB(g)的热化学方程式___.
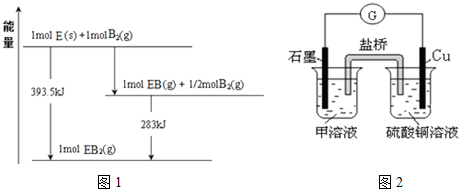
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为___.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物能使湿润的红色石蕊试纸变蓝;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)G元素在周期表中的位置是___.
(2)A与B可组成质量比为7:16的三原子分子,该分子与水反应的化学方程式:___;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH___7(填“>“或“<”或“=”),若所得溶液的pH=7,则a___b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:___.
(5)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g)与E(s)反应生成EB(g)的热化学方程式___.

(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为___.
… E A B C … D … E A B … E A B C … D C … D
22

| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子与水反应的化学方程式:___;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH___7(填“>“或“<”或“=”),若所得溶液的pH=7,则a___b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:___.
(5)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g)与E(s)反应生成EB(g)的热化学方程式___.

(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为___.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物能使湿润的红色石蕊试纸变蓝;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子与水反应的化学方程式:___;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH___7(填“>“或“<”或“=”),若所得溶液的pH=7,则a___b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:___.
(5)已知一定量的E单质能在B2(g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g)与E(s)反应生成EB(g)的热化学方程式___.

(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为___.
| … | E | A | B | ||
| C | … | D |
22

▼优质解答
答案和解析
A、B、C、D、E、F是中学化学中常见的六种短周期元素,A的气态氢化物能使湿润的红色石蕊试纸变蓝,则A为N元素;C单质一般保存在煤油中,则C为Na;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,则F为Al;G单质是日常生活中用量最大的金属,易被腐蚀或损坏,则G为Fe;由元素在周期表中的相对位置可知,E为C元素、B为O元素,D为Cl元素.
(1)G为Fe元素,在元素周期表中位于第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2)N与O可组成质量比为7:16的三原子分子,分子中N原子与氧原子数目之比=
:
=1:2,该分子为NO2,该分子与水反应的化学方程式:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(3)同温同压下,将a L 氨气的气体和b L HCl气体通入水中,如果等体积混合NH3和HCl,完全反应生成NH4Cl,溶液呈酸性,溶液pH<7,若所得溶液的pH=7,则NH3应过量,即a>b,
故答案为:<;>;
(4)Al单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)由图可知,1molC(s)与0.5molO2(g)反应得到1molCO(g)放出热量=393.5kJ-283kJ=110.5kJ,该反应热化学方程式为:C(s)+
O2(g)=CO(g)△H=-110.5kJ/mol ①
1molC(s)与1molO2(g)反应得到1molCO2(g)放出热量393.5kJ,该反应热化学方程式为:
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ②
根据盖斯定律,①×2-②得:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol,
故答案为:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol;
(6)若在Cl与Fe组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,则甲为FeCl3,设计如图所示的原电池,正极上Fe3+获得电子生成Fe2+,正极反应式为:Fe3++e-=Fe2+,
故答案为:Fe3++e-=Fe2+.
7 14 7 7 714 14 14:
=1:2,该分子为NO2,该分子与水反应的化学方程式:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(3)同温同压下,将a L 氨气的气体和b L HCl气体通入水中,如果等体积混合NH3和HCl,完全反应生成NH4Cl,溶液呈酸性,溶液pH<7,若所得溶液的pH=7,则NH3应过量,即a>b,
故答案为:<;>;
(4)Al单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)由图可知,1molC(s)与0.5molO2(g)反应得到1molCO(g)放出热量=393.5kJ-283kJ=110.5kJ,该反应热化学方程式为:C(s)+
O2(g)=CO(g)△H=-110.5kJ/mol ①
1molC(s)与1molO2(g)反应得到1molCO2(g)放出热量393.5kJ,该反应热化学方程式为:
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ②
根据盖斯定律,①×2-②得:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol,
故答案为:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol;
(6)若在Cl与Fe组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,则甲为FeCl3,设计如图所示的原电池,正极上Fe3+获得电子生成Fe2+,正极反应式为:Fe3++e-=Fe2+,
故答案为:Fe3++e-=Fe2+.
16 16 16 16 1616 16 16=1:2,该分子为NO22,该分子与水反应的化学方程式:3NO22+H22O=2HNO33+NO,
故答案为:3NO22+H22O=2HNO33+NO;
(3)同温同压下,将a L 氨气的气体和b L HCl气体通入水中,如果等体积混合NH33和HCl,完全反应生成NH44Cl,溶液呈酸性,溶液pH<7,若所得溶液的pH=7,则NH33应过量,即a>b,
故答案为:<;>;
(4)Al单质与NaOH溶液反应的离子方程式:2Al+2OH--+2H22O=2AlO22--+3H22↑,
故答案为:2Al+2OH--+2H22O=2AlO22--+3H22↑;
(5)由图可知,1molC(s)与0.5molO22(g)反应得到1molCO(g)放出热量=393.5kJ-283kJ=110.5kJ,该反应热化学方程式为:C(s)+
O2(g)=CO(g)△H=-110.5kJ/mol ①
1molC(s)与1molO2(g)反应得到1molCO2(g)放出热量393.5kJ,该反应热化学方程式为:
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ②
根据盖斯定律,①×2-②得:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol,
故答案为:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol;
(6)若在Cl与Fe组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,则甲为FeCl3,设计如图所示的原电池,正极上Fe3+获得电子生成Fe2+,正极反应式为:Fe3++e-=Fe2+,
故答案为:Fe3++e-=Fe2+.
1 2 1 1 12 2 2O22(g)=CO(g)△H=-110.5kJ/mol ①
1molC(s)与1molO22(g)反应得到1molCO22(g)放出热量393.5kJ,该反应热化学方程式为:
C(s)+O22(g)=CO22(g)△H=-393.5kJ/mol ②
根据盖斯定律,①×2-②得:CO22(g)+C(s)=2CO(g)△H=+172.5kJ/mol,
故答案为:CO22(g)+C(s)=2CO(g)△H=+172.5kJ/mol;
(6)若在Cl与Fe组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,则甲为FeCl33,设计如图所示的原电池,正极上Fe3+3+获得电子生成Fe2+2+,正极反应式为:Fe3+3++e--=Fe2+2+,
故答案为:Fe3+3++e--=Fe2+2+.
(1)G为Fe元素,在元素周期表中位于第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2)N与O可组成质量比为7:16的三原子分子,分子中N原子与氧原子数目之比=
| 7 |
| 14 |
| 16 |
| 16 |
故答案为:3NO2+H2O=2HNO3+NO;
(3)同温同压下,将a L 氨气的气体和b L HCl气体通入水中,如果等体积混合NH3和HCl,完全反应生成NH4Cl,溶液呈酸性,溶液pH<7,若所得溶液的pH=7,则NH3应过量,即a>b,
故答案为:<;>;
(4)Al单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)由图可知,1molC(s)与0.5molO2(g)反应得到1molCO(g)放出热量=393.5kJ-283kJ=110.5kJ,该反应热化学方程式为:C(s)+
| 1 |
| 2 |
1molC(s)与1molO2(g)反应得到1molCO2(g)放出热量393.5kJ,该反应热化学方程式为:
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ②
根据盖斯定律,①×2-②得:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol,
故答案为:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol;
(6)若在Cl与Fe组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,则甲为FeCl3,设计如图所示的原电池,正极上Fe3+获得电子生成Fe2+,正极反应式为:Fe3++e-=Fe2+,
故答案为:Fe3++e-=Fe2+.
| 7 |
| 14 |
| 16 |
| 16 |
故答案为:3NO2+H2O=2HNO3+NO;
(3)同温同压下,将a L 氨气的气体和b L HCl气体通入水中,如果等体积混合NH3和HCl,完全反应生成NH4Cl,溶液呈酸性,溶液pH<7,若所得溶液的pH=7,则NH3应过量,即a>b,
故答案为:<;>;
(4)Al单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)由图可知,1molC(s)与0.5molO2(g)反应得到1molCO(g)放出热量=393.5kJ-283kJ=110.5kJ,该反应热化学方程式为:C(s)+
| 1 |
| 2 |
1molC(s)与1molO2(g)反应得到1molCO2(g)放出热量393.5kJ,该反应热化学方程式为:
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ②
根据盖斯定律,①×2-②得:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol,
故答案为:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol;
(6)若在Cl与Fe组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,则甲为FeCl3,设计如图所示的原电池,正极上Fe3+获得电子生成Fe2+,正极反应式为:Fe3++e-=Fe2+,
故答案为:Fe3++e-=Fe2+.
| 16 |
| 16 |
故答案为:3NO22+H22O=2HNO33+NO;
(3)同温同压下,将a L 氨气的气体和b L HCl气体通入水中,如果等体积混合NH33和HCl,完全反应生成NH44Cl,溶液呈酸性,溶液pH<7,若所得溶液的pH=7,则NH33应过量,即a>b,
故答案为:<;>;
(4)Al单质与NaOH溶液反应的离子方程式:2Al+2OH--+2H22O=2AlO22--+3H22↑,
故答案为:2Al+2OH--+2H22O=2AlO22--+3H22↑;
(5)由图可知,1molC(s)与0.5molO22(g)反应得到1molCO(g)放出热量=393.5kJ-283kJ=110.5kJ,该反应热化学方程式为:C(s)+
| 1 |
| 2 |
1molC(s)与1molO2(g)反应得到1molCO2(g)放出热量393.5kJ,该反应热化学方程式为:
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ②
根据盖斯定律,①×2-②得:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol,
故答案为:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol;
(6)若在Cl与Fe组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,则甲为FeCl3,设计如图所示的原电池,正极上Fe3+获得电子生成Fe2+,正极反应式为:Fe3++e-=Fe2+,
故答案为:Fe3++e-=Fe2+.
| 1 |
| 2 |
1molC(s)与1molO22(g)反应得到1molCO22(g)放出热量393.5kJ,该反应热化学方程式为:
C(s)+O22(g)=CO22(g)△H=-393.5kJ/mol ②
根据盖斯定律,①×2-②得:CO22(g)+C(s)=2CO(g)△H=+172.5kJ/mol,
故答案为:CO22(g)+C(s)=2CO(g)△H=+172.5kJ/mol;
(6)若在Cl与Fe组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,则甲为FeCl33,设计如图所示的原电池,正极上Fe3+3+获得电子生成Fe2+2+,正极反应式为:Fe3+3++e--=Fe2+2+,
故答案为:Fe3+3++e--=Fe2+2+.
看了 A、B、C、D、E、F是中学...的网友还看了以下:
按形态分,土壤水存在的形式有()A.固态水B.气态水C.液态水D.地面水E.地下水 2020-05-28 …
在很冷的地区使用酒精温度计,而不使用水银温度计的主要原因是()A.固态水银比固态酒精的熔点高B.液 2020-06-14 …
三态门使能端输入无效信号时,电路外部向内部看呈高阻状态,那么高阻状态在极限状态是什么状态?A.高电 2020-06-23 …
数学懂的过来已知A地高度为3.72米,现在通过B,C,D,E四个中间点,最后测量原出的F地的高度, 2020-07-09 …
高中函数题:设f(x)=x/e^x,a≠b,f(a)=f(b),比较a+b与2的大小我是这么想的但 2020-07-13 …
高数导数问题.设f(x)=(e^x-e^a)g(x)在x=a处可导,则函数g(x)应该满足条件是? 2020-07-20 …
如图,物理实验室有一单摆在左右摆动,摆动过程中选取了两个瞬时状态,从C处测得E、F两点的俯角分别为 2020-07-27 …
有A、B、C、D、E五种短周期元素,已知:①C+、D3+均与E的气态氢化物分子具有相同的电子数;A2 2020-10-31 …
没有农业的现代化,就不可能有整个国民经济的现代化.现代农业需要具备如下特征A高产、高效、高利润、安全 2020-11-05 …
学校的花园里有A,B,C,D,E,F六座假山,小亮和小明要测量A,B两座假山的高度他们测得A的高度为 2020-12-14 …