早教吧作业答案频道 -->化学-->
N、C、S元素的单质及化合物在工农业生成中有着重要的应用Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:C
题目详情
N、C、S元素的单质及化合物在工农业生成中有着重要的应用
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)⇌COCl2(g)反应过程中测定的部分数据如下表:
(1)写出光气(COCl2)的电子式___
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=___.该温度下的平衡常数K=___.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是___(填字母序号).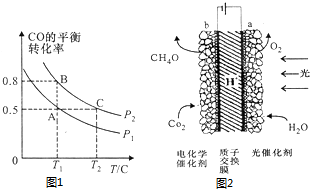
A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)___P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为___L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式___.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向___区移动(填“a”或“b”)
②b极上的电极反应式为___.N、C、S元素的单质及化合物在工农业生成中有着重要的应用
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)⇌COCl2(g)反应过程中测定的部分数据如下表:
(1)写出光气(COCl2)的电子式___
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=___.该温度下的平衡常数K=___.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是___(填字母序号).
A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)___P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为___L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式___.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向___区移动(填“a”或“b”)
②b极上的电极反应式为___.
22222
t/min n(CO)/mol n(Cl2)/mol 0 1.20 0.6 1 0.90 2 0.80 4 0.20 t/min n(CO)/mol n(Cl2)/mol t/min n(CO)/mol n(Cl2)/mol 2 0 1.20 0.6 0 1.20 0.6 1 0.90 1 0.90 2 0.80 2 0.80 4 0.20 4 0.20 2
222
2

22
2
2
2
2
322
2223
+
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)⇌COCl2(g)反应过程中测定的部分数据如下表:
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.6 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=___.该温度下的平衡常数K=___.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是___(填字母序号).

A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)___P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为___L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式___.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向___区移动(填“a”或“b”)
②b极上的电极反应式为___.N、C、S元素的单质及化合物在工农业生成中有着重要的应用
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)⇌COCl2(g)反应过程中测定的部分数据如下表:
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.6 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=___.该温度下的平衡常数K=___.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是___(填字母序号).

A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)___P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为___L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式___.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向___区移动(填“a”或“b”)
②b极上的电极反应式为___.
22222
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.6 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
222
2

22
2
2
2
2
322
2223
+
▼优质解答
答案和解析
I.(1)结构式为: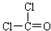 ,每个氯原子还含有3个孤电子对、O原子还含有2个孤电子对,其电子式为
,每个氯原子还含有3个孤电子对、O原子还含有2个孤电子对,其电子式为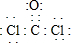 ,故答案为:
,故答案为: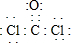 ;
;
(2)2min内参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,生成n(COCl22)=n(CO)(反应)=0.40mol,则v(COCl22)=
=
=0.1mol/(L.min);
根据表中数据知,4min时参加反应的n(Cl2)=0.60mol-0.20mol=0.40mol,2min时参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,参加反应的氯气和CO的物质的量相等,所以2min时该反应达到平衡状态,
该反应CO(g)+Cl2(g)⇌COCl2(g)
开始(mol)1.20 0.60 0
反应(mol)0.40 0.40 0.40
平衡(mol)0.80 0.20 0.40
平衡时c(CO)=
=0.40mol/L、c(Cl2)=
=0.10mol/L、c(COCl2)=
=0.20mol/L,
化学平衡常数K=
=
=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
△t
△n V △n △n △nV V V△t △t △t=
=0.1mol/(L.min);
根据表中数据知,4min时参加反应的n(Cl2)=0.60mol-0.20mol=0.40mol,2min时参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,参加反应的氯气和CO的物质的量相等,所以2min时该反应达到平衡状态,
该反应CO(g)+Cl2(g)⇌COCl2(g)
开始(mol)1.20 0.60 0
反应(mol)0.40 0.40 0.40
平衡(mol)0.80 0.20 0.40
平衡时c(CO)=
=0.40mol/L、c(Cl2)=
=0.10mol/L、c(COCl2)=
=0.20mol/L,
化学平衡常数K=
=
=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
2min
0.40mol 2L 0.40mol 0.40mol 0.40mol2L 2L 2L2min 2min 2min=0.1mol/(L.min);
根据表中数据知,4min时参加反应的n(Cl22)=0.60mol-0.20mol=0.40mol,2min时参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,参加反应的氯气和CO的物质的量相等,所以2min时该反应达到平衡状态,
该反应CO(g)+Cl22(g)⇌COCl22(g)
开始(mol)1.20 0.60 0
反应(mol)0.40 0.40 0.40
平衡(mol)0.80 0.20 0.40
平衡时c(CO)=
=0.40mol/L、c(Cl2)=
=0.10mol/L、c(COCl2)=
=0.20mol/L,
化学平衡常数K=
=
=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
0.80mol 2L 0.80mol 0.80mol 0.80mol2L 2L 2L=0.40mol/L、c(Cl22)=
=0.10mol/L、c(COCl2)=
=0.20mol/L,
化学平衡常数K=
=
=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
0.20mol 2L 0.20mol 0.20mol 0.20mol2L 2L 2L=0.10mol/L、c(COCl22)=
=0.20mol/L,
化学平衡常数K=
=
=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
0.40mol 2L 0.40mol 0.40mol 0.40mol2L 2L 2L=0.20mol/L,
化学平衡常数K=
=
=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
c(COCl2) c(CO).c(Cl2) c(COCl2) c(COCl2) c(COCl2)2)c(CO).c(Cl2) c(CO).c(Cl2) c(CO).c(Cl2)2)=
=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
0.20 0.40×0.10 0.20 0.20 0.200.40×0.10 0.40×0.10 0.40×0.10=5,
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl22的消耗速率等于COCl22的生成速率,不能据此判断平衡状态,故错误;
B.Cl22的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl22的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1122,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl22(g)⇌COCl22(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
0.25 0.25×0.75 0.25 0.25 0.250.25×0.75 0.25×0.75 0.25×0.75=
,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
4 3 4 4 43 3 3,因A、B反应温度相等,则平衡常数相等,且B点时CO的转化率为80%,
则 CO(g)+Cl22(g)⇌COCl22(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
×
8 V 8 8 8V V V
×
×
2 V 2 2 2V V V×
12 V 12 12 12V V V=
,V=4
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
4 3 4 4 43 3 3,V=4
故答案为:4;
II.(1)由CO(g)和CH33OH(l)的燃烧热△H分别为-283.0kJ•mol-1-1和-726.5kJ•mol-1-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
1 2 1 1 12 2 2O22(g)=CO22(g)△H=-283.0kJ•mol-1-1
②CH33OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
3 2 3 3 32 2 2O22(g)=CO22(g)+2 H22O(l)△H=-726.5kJ•mol-1-1
③H22(g)+
O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
1 2 1 1 12 2 2O22(g)=H22O(l)△H=-286kJ•mol-1-1
由盖斯定律可知用①+③-
×②得反应CO(g)+2H2(g)=CH3OH(l
2 3 2 2 23 3 3×②得反应CO(g)+2H22(g)=CH33OH(l
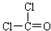 ,每个氯原子还含有3个孤电子对、O原子还含有2个孤电子对,其电子式为
,每个氯原子还含有3个孤电子对、O原子还含有2个孤电子对,其电子式为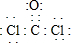 ,故答案为:
,故答案为: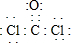 ;
;(2)2min内参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,生成n(COCl22)=n(CO)(反应)=0.40mol,则v(COCl22)=
| ||
| △t |
| ||
| 2min |
根据表中数据知,4min时参加反应的n(Cl2)=0.60mol-0.20mol=0.40mol,2min时参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,参加反应的氯气和CO的物质的量相等,所以2min时该反应达到平衡状态,
该反应CO(g)+Cl2(g)⇌COCl2(g)
开始(mol)1.20 0.60 0
反应(mol)0.40 0.40 0.40
平衡(mol)0.80 0.20 0.40
平衡时c(CO)=
| 0.80mol |
| 2L |
| 0.20mol |
| 2L |
| 0.40mol |
| 2L |
化学平衡常数K=
| c(COCl2) |
| c(CO).c(Cl2) |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| ||
| △t |
| △n |
| V |
| △n |
| V |
| △n |
| V |
| △n |
| V |
| ||
| 2min |
根据表中数据知,4min时参加反应的n(Cl2)=0.60mol-0.20mol=0.40mol,2min时参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,参加反应的氯气和CO的物质的量相等,所以2min时该反应达到平衡状态,
该反应CO(g)+Cl2(g)⇌COCl2(g)
开始(mol)1.20 0.60 0
反应(mol)0.40 0.40 0.40
平衡(mol)0.80 0.20 0.40
平衡时c(CO)=
| 0.80mol |
| 2L |
| 0.20mol |
| 2L |
| 0.40mol |
| 2L |
化学平衡常数K=
| c(COCl2) |
| c(CO).c(Cl2) |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| ||
| 2min |
| 0.40mol |
| 2L |
| 0.40mol |
| 2L |
| 0.40mol |
| 2L |
| 0.40mol |
| 2L |
根据表中数据知,4min时参加反应的n(Cl22)=0.60mol-0.20mol=0.40mol,2min时参加反应的n(CO)=1.20mol-0.80mol=0.40mol,根据方程式知,参加反应的氯气和CO的物质的量相等,所以2min时该反应达到平衡状态,
该反应CO(g)+Cl22(g)⇌COCl22(g)
开始(mol)1.20 0.60 0
反应(mol)0.40 0.40 0.40
平衡(mol)0.80 0.20 0.40
平衡时c(CO)=
| 0.80mol |
| 2L |
| 0.20mol |
| 2L |
| 0.40mol |
| 2L |
化学平衡常数K=
| c(COCl2) |
| c(CO).c(Cl2) |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 0.80mol |
| 2L |
| 0.20mol |
| 2L |
| 0.40mol |
| 2L |
化学平衡常数K=
| c(COCl2) |
| c(CO).c(Cl2) |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 0.20mol |
| 2L |
| 0.40mol |
| 2L |
化学平衡常数K=
| c(COCl2) |
| c(CO).c(Cl2) |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 0.40mol |
| 2L |
化学平衡常数K=
| c(COCl2) |
| c(CO).c(Cl2) |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| c(COCl2) |
| c(CO).c(Cl2) |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl2的消耗速率等于COCl2的生成速率,不能据此判断平衡状态,故错误;
B.Cl2的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl2的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P1<P2,故答案为:<;
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl2(g)⇌COCl2(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 0.20 |
| 0.40×0.10 |
故答案为:0.1mol/(L.min);5;
(3)①A.无论反应是否达到平衡状态,都存在Cl22的消耗速率等于COCl22的生成速率,不能据此判断平衡状态,故错误;
B.Cl22的体积分数不变,正逆反应速率相等,反应达到平衡状态,故正确;
C.Cl22的转化率和CO的转化率相等时,正逆反应速率不相等,该反应没有达到平衡状态,故错误;
D.反应前后气体物质的量减小、总质量不变,则反应前后气体平均摩尔质量增大,当混合气体的平均摩尔质量不再改变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选BD;
②相同温度下,增大压强平衡正向移动,CO转化率增大,所以P11
③当达到平衡状态A时,容器的体积为10L,此时CO的转化率为50%,则
CO(g)+Cl22(g)⇌COCl22(g)
起始(mol/L):0.5 1 0
转化(mol/L):0.25 0.25 0.25
平衡(mol/L):0.25 0.75 0.25
k=
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 0.25 |
| 0.25×0.75 |
| 4 |
| 3 |
则 CO(g)+Cl2(g)⇌COCl2(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 4 |
| 3 |
则 CO(g)+Cl22(g)⇌COCl22(g)
起始(mol):10 20 0
转化(mol):8 8 8
平衡(mol):2 12 8
设体积为VL,则
化学平衡常数K=
| ||||
|
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| ||||
|
| 8 |
| V |
| 2 |
| V |
| 12 |
| V |
| 8 |
| V |
| 8 |
| V |
| 8 |
| V |
| 2 |
| V |
| 12 |
| V |
| 2 |
| V |
| 12 |
| V |
| 2 |
| V |
| 12 |
| V |
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 4 |
| 3 |
故答案为:4;
II.(1)由CO(g)和CH33OH(l)的燃烧热△H分别为-283.0kJ•mol-1-1和-726.5kJ•mol-1-1,则
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 1 |
| 2 |
②CH33OH(l)+
| 3 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 3 |
| 2 |
③H22(g)+
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 1 |
| 2 |
由盖斯定律可知用①+③-
| 2 |
| 3 |
| 2 |
| 3 |
看了 N、C、S元素的单质及化合物...的网友还看了以下:
催化剂在化工生产过程中有着重要作用有的反应如果没有催化剂就不能进行大多数化工生产都有催化剂的参与。 2020-04-11 …
催化剂在化工生产过程中有着重要作用有的反应如果没有催化剂就不能进行大多数化工生产都有催化剂的参与。 2020-05-13 …
下列有关化工生产的说法正确的是()A.工业生产硫酸时,常用NaOH吸收尾气中的少量SO2B.利用F 2020-05-14 …
化工生产中一定要使用催化剂吗?催化剂的作用是什么? 2020-06-04 …
(2014•南通二模)催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺.(1)人们常用催 2020-06-09 …
化工生产中,阻聚空气和阻聚剂各自的阻聚原理在化工生产中,我们经常需要使用阻聚空气和阻聚剂,阻聚空气 2020-06-23 …
(2右d4•广东模拟)绿色化学工艺的特点可以用原子经济化、原料绿色化、催化剂绿色化、溶液绿色化、产品 2020-10-31 …
如图是某化工厂设计的基础化工生产流程,回答问题.(1)白色固体A中,可用作某些气体干燥剂的成分是;( 2020-11-04 …
乙醚是化工生产中重要的溶剂,也用作药物生产的萃取剂和医疗上的麻醉剂.实验室通过乙醇脱水制备:原理2C 2020-11-29 …
乙醚是化工生产中重要的溶剂,也用作药物生产的萃取剂和医疗上的麻醉剂.实验室通过乙醇脱水制备:原理2C 2020-12-14 …