早教吧作业答案频道 -->化学-->
实验室欲用NaOH固体配制1.0mol/L的NaOH溶液240mL:(1)配制溶液时,一般可以分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却其正确的操作顺序为.
题目详情
实验室欲用NaOH固体配制1.0mol/L的NaOH溶液240mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为___.本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、___.
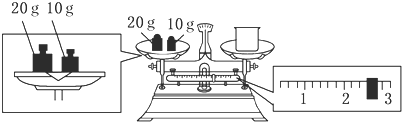
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为___ g,要完成本实验该同学应称出___ g NaOH.
(3)使用容量瓶前必须进行的一步操作是___.
(4)在配制过程中,其他操作都是正确的,下列操作会引起所配溶液浓度偏高的是___.
①洗涤烧杯和玻璃棒,并将洗涤液倒入水槽中
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
⑦若将氢氧化钠固体放纸上称量
(5)氢氧化钠溶液配好后应贮存在___.

(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为___.本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、___.
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为___ g,要完成本实验该同学应称出___ g NaOH.
(3)使用容量瓶前必须进行的一步操作是___.
(4)在配制过程中,其他操作都是正确的,下列操作会引起所配溶液浓度偏高的是___.
①洗涤烧杯和玻璃棒,并将洗涤液倒入水槽中
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
⑦若将氢氧化钠固体放纸上称量
(5)氢氧化钠溶液配好后应贮存在___.
▼优质解答
答案和解析
(1)实验室中没有240mL的容量瓶,配制时需要选用250mL的容量瓶,配制250mL1.0mol/L的NaOH溶液的步骤为:计算→称量→溶解、冷却→移液→定容→摇匀→装瓶→贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,所以正确的操作顺序为:②①③⑧⑤⑥⑦④;需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,还缺少250mL容量瓶,
故答案为:②①③⑧⑤⑥⑦④;250ml容量瓶、胶头滴管;
(2)根据图示可知,游码的读数为2.6g,结合托盘天平的称量原理可知,图示中,砝码质量=烧杯质量+游码质量,所以烧杯质量=砝码质量-游码质量=20g+10g-2.6g=27.4g;配制250mL1.0mol/L的NaOH溶液,需要氢氧化钠的质量为:0.25L×1mol/L×40g/mol=10.0g,
故答案为:27.4;10.0;
(3)容量瓶有瓶塞,配制过程中需要摇匀,为了避免液体流出,配制溶液之前需要据此容量瓶是否漏水,
故答案为:检验容量瓶是否漏水;
(4)①洗涤烧杯和玻璃棒,并将洗涤液倒入水槽中,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故①错误;
②转移溶液时不慎有少量洒到容量瓶外面,导致配制的溶液中溶质的物质的量偏小,溶液浓度偏低,故②错误;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量及溶液的最终体积都没有影响,不影响配制结果,故③错误;
④定容时俯视刻度线,导致加入的蒸馏水体积低于容量瓶刻度线,配制的溶液体积偏小,溶液浓度偏高,故④正确;
⑤未冷却到室温就将溶液转移到容量瓶并定容,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,溶液浓度偏高,故⑤正确;
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致配制的溶液体积偏大,溶液浓度偏低,故⑥错误;
⑦若将氢氧化钠固体放纸上称量,氢氧化钠容易潮解、变质,导致称量的氢氧化钠的质量偏小,配制的溶液中氢氧化钠的物质的量偏小,配制的溶液溶液浓度偏低,故⑦错误;
故答案为:④⑤;
(5)氢氧化钠溶液具有强腐蚀性,能够与二氧化硅反应,不能所以玻璃塞,所以储存氢氧化钠溶液的方法为:放在细口试剂瓶中,加盖橡胶塞,
故答案为:细口试剂瓶中,加盖橡胶塞.
故答案为:②①③⑧⑤⑥⑦④;250ml容量瓶、胶头滴管;
(2)根据图示可知,游码的读数为2.6g,结合托盘天平的称量原理可知,图示中,砝码质量=烧杯质量+游码质量,所以烧杯质量=砝码质量-游码质量=20g+10g-2.6g=27.4g;配制250mL1.0mol/L的NaOH溶液,需要氢氧化钠的质量为:0.25L×1mol/L×40g/mol=10.0g,
故答案为:27.4;10.0;
(3)容量瓶有瓶塞,配制过程中需要摇匀,为了避免液体流出,配制溶液之前需要据此容量瓶是否漏水,
故答案为:检验容量瓶是否漏水;
(4)①洗涤烧杯和玻璃棒,并将洗涤液倒入水槽中,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故①错误;
②转移溶液时不慎有少量洒到容量瓶外面,导致配制的溶液中溶质的物质的量偏小,溶液浓度偏低,故②错误;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量及溶液的最终体积都没有影响,不影响配制结果,故③错误;
④定容时俯视刻度线,导致加入的蒸馏水体积低于容量瓶刻度线,配制的溶液体积偏小,溶液浓度偏高,故④正确;
⑤未冷却到室温就将溶液转移到容量瓶并定容,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,溶液浓度偏高,故⑤正确;
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致配制的溶液体积偏大,溶液浓度偏低,故⑥错误;
⑦若将氢氧化钠固体放纸上称量,氢氧化钠容易潮解、变质,导致称量的氢氧化钠的质量偏小,配制的溶液中氢氧化钠的物质的量偏小,配制的溶液溶液浓度偏低,故⑦错误;
故答案为:④⑤;
(5)氢氧化钠溶液具有强腐蚀性,能够与二氧化硅反应,不能所以玻璃塞,所以储存氢氧化钠溶液的方法为:放在细口试剂瓶中,加盖橡胶塞,
故答案为:细口试剂瓶中,加盖橡胶塞.
看了 实验室欲用NaOH固体配制1...的网友还看了以下:
下列实验操作(或方案)不能达到实验目的是()序号实验操作(或方案)实验目的A取两块干燥的玻璃片,对 2020-04-09 …
在化学实验操作中,往往由于读数不规范导致较大的实验误差.下列有关实验中,会导致所配制(或所测定)溶 2020-05-14 …
在今年的实验操作考试中,吴丽同学抽到“探究串联电路电压的规律”的实验,其实验过程如下:(1)她在检 2020-06-22 …
如图是“粗盐中难溶性杂质的去除”的实验操作示意图:(1)仪器a的名称;(2)操作A中托盘两边各放一 2020-07-29 …
1.试设计一个简单实验,证明醋酸是一种弱电解质(简述操作,现象及结论)2.在进行沉淀反应的实验时,如 2020-11-26 …
草木灰富含钾盐,主要成分是碳酸钾.现在从草木灰中提取钾盐,并用实验检验其中的SO4离子、CO3离子和 2020-12-02 …
草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾.现从草木灰中提取钾盐,并用实验检验其中的CO2 2020-12-02 …
(1)某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3 2020-12-05 …
小刚的笔记有对化学实验“目的-操作-现象-结论”的描述,其中不正确的是实验过程组别实验目的实验操作实 2021-01-22 …
实验室有一瓶亚硫酸钠试剂,已经被氧化成硫酸钠.某学生设计如下实验来确定其纯度.已知往溶液里加盐酸发生 2021-02-01 …