早教吧作业答案频道 -->化学-->
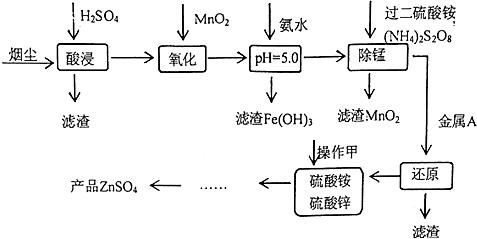
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.下图是用高炉烟尘制取硫酸锌的工业流程.已知:①20℃时,0.1mol.L-1的金
题目详情
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.下图是用高炉烟尘制取硫酸锌的工业流程.
已知:
①20℃时,0.1mol.L-1的金属离子沉淀时的pH
②过二硫酸铵是一种强氧化剂.
③ZnSO4+4NH3═[Zn(NH3)4]SO4,[Zn(NH3)4]SO4易溶于水.
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?(举出1种)___.
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是___.
(3)加入MnO2的目的是___.
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式___.
(5)写出还原过程发生的主要反应的离子方程式___.
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是___
A.锌粉 B.氨水 C.( NH4)2CO3 D.NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值___.

已知:
①20℃时,0.1mol.L-1的金属离子沉淀时的pH
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
③ZnSO4+4NH3═[Zn(NH3)4]SO4,[Zn(NH3)4]SO4易溶于水.
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?(举出1种)___.
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是___.
(3)加入MnO2的目的是___.
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式___.
(5)写出还原过程发生的主要反应的离子方程式___.
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是___
A.锌粉 B.氨水 C.( NH4)2CO3 D.NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值___.
▼优质解答
答案和解析
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素,用硫酸酸浸,过滤得到滤液中含有锌离子、亚铁离子、铜离子等,用二氧化锰氧化亚铁离子生成铁离子,再加氨水调节pH值使铁离子转化为氢氧化铁沉淀,过滤除去,用过二硫酸铵除去锰离子,再加入足量的锌除去铜离子,得到硫酸铵、硫酸锌的混合溶液,在溶液中加足量的( NH4)2CO3 使锌离子完全沉淀,过滤分离后用硫酸溶解得到硫酸锌,
(1)升高温度、搅拦、增加浸出时间等可以提高烟尘中金属离子的浸出率,
故答案为:升高温度;
(2)测得溶液pH=5.0,可以选用pH计测定,
故答案为:pH计;
(3)加入MnO2可以将亚铁离子氧化成铁离子,通过调节溶液pH使铁离子转化为氢氧化铁沉淀除去,
故答案为:将Fe2+氧化成Fe3+;
(4)过二硫酸铵和硫酸锰反应生成二氧化锰、硫酸铵、硫酸,反应的化学方程式为:MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4,
故答案为:MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4;
(5)还原过程中锌置换出铜,反应的离子方程式为:Zn+Cu2+=Zn2++Cu,
故答案为:Zn+Cu2+=Zn2++Cu;
(6)由于在前面的步骤中已经加过锌,所以锌不能使锌离子完全沉淀,氨水与锌离子形成配合离子溶于水,氢氧化钠会引入新杂质,所以要使锌离子完全沉淀,只能用碳酸铵,
故答案为:C;
(7)根据0.1mol.L-1Cu2+开始沉淀时pH=4.7,可知Ksp[Cu(OH)2]=0.1×(10-9.3)2=10-19.6,根据Ksp可知pH=5.0时,所以溶液中的Cu2+浓度的最大值为:
mol/L=10-1.6mol/L,
故答案为:10-1.6mol/L.
(1)升高温度、搅拦、增加浸出时间等可以提高烟尘中金属离子的浸出率,
故答案为:升高温度;
(2)测得溶液pH=5.0,可以选用pH计测定,
故答案为:pH计;
(3)加入MnO2可以将亚铁离子氧化成铁离子,通过调节溶液pH使铁离子转化为氢氧化铁沉淀除去,
故答案为:将Fe2+氧化成Fe3+;
(4)过二硫酸铵和硫酸锰反应生成二氧化锰、硫酸铵、硫酸,反应的化学方程式为:MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4,
故答案为:MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4;
(5)还原过程中锌置换出铜,反应的离子方程式为:Zn+Cu2+=Zn2++Cu,
故答案为:Zn+Cu2+=Zn2++Cu;
(6)由于在前面的步骤中已经加过锌,所以锌不能使锌离子完全沉淀,氨水与锌离子形成配合离子溶于水,氢氧化钠会引入新杂质,所以要使锌离子完全沉淀,只能用碳酸铵,
故答案为:C;
(7)根据0.1mol.L-1Cu2+开始沉淀时pH=4.7,可知Ksp[Cu(OH)2]=0.1×(10-9.3)2=10-19.6,根据Ksp可知pH=5.0时,所以溶液中的Cu2+浓度的最大值为:
| 10-19.6 |
| (10-9)2 |
故答案为:10-1.6mol/L.
看了 高炉炼铁的烟尘中主要含有锌、...的网友还看了以下:
氮可以形成多种化合物,如NO、MH3、N2H4、NO2、N2O5等.(1)己知:N2(g)+2H2 2020-04-07 …
已知中和热的数值是57.3kJ•mol-1.下列物质反应时,产生57.3kJ热量的是()A.稀HC 2020-04-08 …
为了证明一水合氨(NH3.H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:0.01mo 2020-05-13 …
已知抛物线y2=2px(p>0)的焦点为F,准线为l.(1)求抛物线上任意一点Q到定点N(2p,0 2020-05-13 …
如图1,在△ABC中,∠ACB=90°,AC=BC,直线l经过顶点C,过A、B两点分别作l的垂线A 2020-05-20 …
在A.L.Sally的1-9比率标度法中,标度5表示—个指标比另—个指标稍微重要。()A.正确B.错 2020-05-21 …
液态化合物在一定量的氧气中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)=XO2(g)+2 2020-06-05 …
液态化合物在一定量的氧气中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)=XO2(g)+2 2020-06-05 …
如图所示,小球的质量为m,带电量为q,悬挂小球的丝线与竖直方向成θ角时,小球恰好在匀强电场中静止不 2020-06-12 …
己知有机物A是一种重要的化工原料,其在标准状况下的密度为1.25g/L.(1)C中的官能团名称;⑥ 2020-06-19 …