早教吧作业答案频道 -->化学-->
PbI2是生产新型敏化太阳能电池的敏化剂--甲胺铅碘的原料.合成PbI2的实验流程如下:(1)将铅块制成铅花的目的是.(2)31.05g铅花用5.00mol•L-1的硝酸溶解,至少需消耗5.00mol•L-1硝酸mL
题目详情
PbI2是生产新型敏化太阳能电池的敏化剂--甲胺铅碘的原料.合成PbI2的实验流程如下:
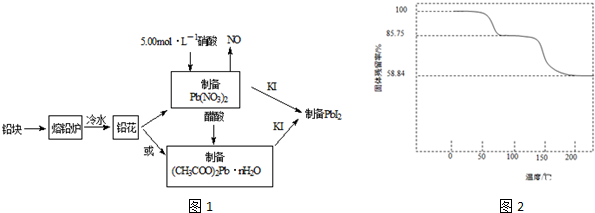
(1)将铅块制成铅花的目的是___.
(2)31.05g铅花用5.00mol•L-1的硝酸溶解,至少需消耗5.00mol•L-1硝酸___mL,同时产生___L(标准状况下)NO.
(3)取一定质量(CH3COO)2Pb•nH2O样品在N2气氛中加热,测得样品固体残留率(
×100%)随温度的变化如图所示(已知:样品在75℃时已完全失去结晶水).
①(CH3COO)2Pb•nH2O中结晶水数目n=___(填数字).
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为___(写结构简式).
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s)+Pb2+(aq)=R2Pb(s)+2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中.加入2~3滴酚酞溶液,用0.002500mol•L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL.计算室温时PbI2 的Ksp (请给出计算过程).

(1)将铅块制成铅花的目的是___.
(2)31.05g铅花用5.00mol•L-1的硝酸溶解,至少需消耗5.00mol•L-1硝酸___mL,同时产生___L(标准状况下)NO.
(3)取一定质量(CH3COO)2Pb•nH2O样品在N2气氛中加热,测得样品固体残留率(
| 固体样品的剩余质量 |
| 固体样品的起始质量 |
①(CH3COO)2Pb•nH2O中结晶水数目n=___(填数字).
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为___(写结构简式).
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mLPbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s)+Pb2+(aq)=R2Pb(s)+2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中.加入2~3滴酚酞溶液,用0.002500mol•L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL.计算室温时PbI2 的Ksp (请给出计算过程).
▼优质解答
答案和解析
(1)将铅块制成铅花,是为了增大与酸反应的接触面积,加快溶解反应速率,
故答案为:增大与酸的接触面,加快溶解反应速率;
(2)31.05g铅的物质的量为
=0.15mol,根据反应方程式可知消耗的HNO3的物质的量为0.15mol×
=0.4mol,生成的NO的物质的量为0.15mol×
=0.1mol,则硝酸溶液的体积为0.4mol÷5.00mol•L-1=0.08L=80.0mL,生成NO的体积为0.1mol×22.4L/mol=2.24L,
故答案为:80.0;2.24;
(3)①假设样品的起始质量为100克,根据固体残留率的公式可知,75℃时剩余固体为87.75克,生成的水质量为100g-87.75g=12.25g,则醋酸铅与水的物质的量之比为
:
=1:3,则n=3,
故答案为:3;
②铅的氧化物质量为58.84克,醋酸铅的物质的量为=
=
mol,根据铅原子守恒,铅的氧化物(PbOx)的物质的量为=
mol,此氧化物的摩尔质量为58.84g÷=
mol=223g/mol,为PbO,有机物的质量为85.75g-58.84g=26.91g,此有机物分子内应含有四个碳原子,物质的量为=
mol,摩尔质量为26.91g÷=
mol=102,根据原子守恒可知有机物的分子式为C4H6O3,结构简式为(CH3CO)2O,
故答案为:(CH3CO)2O;
(4)n(H+)=n(NaOH)=0.002500 mol•L-1×20.00mL×10-3L•mL-1=5.000×10-5mol,
n[Pb2+(aq)]=
n(H+)=2.500×10-5mol,
c(Pb2+)=
=1.000×10-3 mol•L-1
Ksp(PbI2)=c(Pb2+)•c2(I-)=4c3(Pb2+)=4×(1.000×10-3)3=4.000×10-9,
答:室温时PbI2 的Ksp 为4.000×10-9.
故答案为:增大与酸的接触面,加快溶解反应速率;
(2)31.05g铅的物质的量为
| 31.05g |
| 207g/mol |
| 8 |
| 3 |
| 2 |
| 3 |
故答案为:80.0;2.24;
(3)①假设样品的起始质量为100克,根据固体残留率的公式可知,75℃时剩余固体为87.75克,生成的水质量为100g-87.75g=12.25g,则醋酸铅与水的物质的量之比为
| 85.75g |
| 325g/mol |
| 12.25g |
| 18g/mol |
故答案为:3;
②铅的氧化物质量为58.84克,醋酸铅的物质的量为=
| 85.75g |
| 325g/mol |
| 85.75 |
| 325 |
| 85.75 |
| 325 |
| 85.75 |
| 325 |
| 85.75 |
| 325 |
| 85.75 |
| 325 |
故答案为:(CH3CO)2O;
(4)n(H+)=n(NaOH)=0.002500 mol•L-1×20.00mL×10-3L•mL-1=5.000×10-5mol,
n[Pb2+(aq)]=
| 1 |
| 2 |
c(Pb2+)=
| 2.500×10 -5mol |
| 25.00mL×10 -3L/mL |
Ksp(PbI2)=c(Pb2+)•c2(I-)=4c3(Pb2+)=4×(1.000×10-3)3=4.000×10-9,
答:室温时PbI2 的Ksp 为4.000×10-9.
看了 PbI2是生产新型敏化太阳能...的网友还看了以下:
(2013•新余二模)(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入 2020-05-13 …
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al³+)=0.4mol/L,c(SO4²- 2020-05-13 …
将硫酸钾,硫酸铝,硫酸钾铝三种盐混合溶于硫酸酸化的水中,测得c(SO42-)=0.105mol/L 2020-05-13 …
(1)0·01mol/L的醋酸溶液与0·01mol/L的盐酸溶液稀释相同倍数后PH哪一个大?(2) 2020-05-17 …
某温度下,0.1mol/L醋酸溶液的ph=3.将该温度下0.2mol/L醋酸溶液和0.2mol/L 2020-05-20 …
高二化学:已知某酸H2A是强酸,实验表明0.1mol/L的H2A溶液中c(H+)=0.11ml/L 2020-05-24 …
烧杯中的溶液经处理得硫酸亚铁晶体.准确称取晶体0.5000g置于锥形瓶中,加入10ml3mol/L 2020-06-26 …
高锰酸钾标准滴定溶液c(1/5KMnO4)=0.01mol/L和草酸标准滴定溶液c(1/2H2C2 2020-07-09 …
科学家提出酸度新概念--AG,用AG表示溶液酸碱性强弱,能克服pH表示溶液酸碱度的缺点,AG=lg 2020-07-12 …
将0.1mol/L的K2SO4溶液,0.2mol/L的AL2(SO4)2溶液和纯水混合,要使混和液 2020-07-16 …