早教吧作业答案频道 -->化学-->
葡萄酒常用Na2S2O5做抗氧化剂.(1)1.90gNa2S2O5最多能还原mLO2(标准状况).(2)0.5molNa2S2O5溶解于水配成1L溶液,该溶液pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图所示.写出Na2S2O
题目详情
葡萄酒常用Na2S2O5做抗氧化剂.
(1)1.90g Na2S2O5最多能还原___mLO2(标准状况).
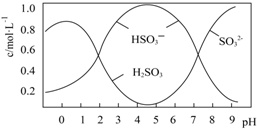
(2)0.5mol Na2S2O5溶解于水配成1L溶液,该溶液pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图所示.写出Na2S2O5溶解于水的化学方程式___;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是___.
已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7.把部分被空气氧化的该溶液pH调为10,向溶液中滴加BaCl2使SO42-沉淀完全[c(SO42-)≤1×10-5mol•L-1],此时溶液中
c(SO32-)≤___mol•L-1.
(3)葡萄酒样品中抗氧化剂的残留量测定(已知:SO2+I2+2H2O=H2SO4+2HI):准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分.取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为0.0225mol•L-1标准I2溶液滴定至终点,消耗标准I2溶液16.02mL.重复以上操作,消耗标准I2溶液15.98mL.计算葡萄酒样品中抗
氧化剂的残留量 (单位:mg•L-1,以SO2计算,请给出计算过程.)

(1)1.90g Na2S2O5最多能还原___mLO2(标准状况).
(2)0.5mol Na2S2O5溶解于水配成1L溶液,该溶液pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图所示.写出Na2S2O5溶解于水的化学方程式___;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是___.
已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7.把部分被空气氧化的该溶液pH调为10,向溶液中滴加BaCl2使SO42-沉淀完全[c(SO42-)≤1×10-5mol•L-1],此时溶液中
c(SO32-)≤___mol•L-1.
(3)葡萄酒样品中抗氧化剂的残留量测定(已知:SO2+I2+2H2O=H2SO4+2HI):准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分.取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为0.0225mol•L-1标准I2溶液滴定至终点,消耗标准I2溶液16.02mL.重复以上操作,消耗标准I2溶液15.98mL.计算葡萄酒样品中抗
氧化剂的残留量 (单位:mg•L-1,以SO2计算,请给出计算过程.)
▼优质解答
答案和解析
(1)在Na2S2O5与O2的反应中,硫从+4价升为+6价,氧从0价降为-2价,1.90g Na2S2O5的物质的量为0.01mol,根据电子得失守恒可知能还原氧气的物质的量为0.01mol,即标准状况224mL,
故答案为:224;
(2)根据图可知,pH=4.5时,溶液中主要以亚硫酸氢根离子形式存在,所以水解方程式为Na2S2O5+H2O=2NaHSO3,当溶液pH小于1后,溶液中主要以亚硫酸形成存在,但亚硫酸不稳定,易分解生成二氧化硫或亚硫酸被氧化也会导致浓度小,
根据Ksp[BaSO4]=c(Ba2+)•c(SO42-),可知需要c(Ba2+)=
=
=10-5mol•L-1,则溶液中SO32-的最大浓度c(SO32-)=
=
=0.05mol•L-1,
故答案为:Na2S2O5+H2O=2NaHSO3;亚硫酸不稳定,易分解生成二氧化硫,或亚硫酸被氧化;0.05;
(3)根据题意可知,消耗标准I2溶液的体积为
=16.0mL,所以I2的物质的量为16.0×10-3L×0.0225mol•L-1=3.6×10-4mol,根据反应SO2+I2+2H2O=H2SO4+2HI,可知二氧化硫的物质的量为3.6×10-4mol,SO2的质量为64g/mol×3.6×10-4mol=23.04mg,所以葡萄酒样品中抗氧化剂的残留量为
=230.4mg•L-1,
故答案为:230.4mg•L-1.
故答案为:224;
(2)根据图可知,pH=4.5时,溶液中主要以亚硫酸氢根离子形式存在,所以水解方程式为Na2S2O5+H2O=2NaHSO3,当溶液pH小于1后,溶液中主要以亚硫酸形成存在,但亚硫酸不稳定,易分解生成二氧化硫或亚硫酸被氧化也会导致浓度小,
根据Ksp[BaSO4]=c(Ba2+)•c(SO42-),可知需要c(Ba2+)=
| Ksp(BaSO4) |
| c(SO42-) |
| 1×10-10 |
| 1×10-5 |
| Ksp(BaSO3) |
| c(Ba2+) |
| 5×10-7 |
| 10-5 |
故答案为:Na2S2O5+H2O=2NaHSO3;亚硫酸不稳定,易分解生成二氧化硫,或亚硫酸被氧化;0.05;
(3)根据题意可知,消耗标准I2溶液的体积为
| 15.98mL+16.02mL |
| 2 |
| 23.04mg |
| 0.1L |
故答案为:230.4mg•L-1.
看了 葡萄酒常用Na2S2O5做抗...的网友还看了以下:
高中化学题,想确定一下答案,各位大侠帮帮忙在11P+15CuSO4+24H2O==5Cu3P+6H 2020-04-25 …
有一条多肽链,分子式为CxHyOpNqS,将它彻底水解后只得到下列四种氨基酸半胱氨酸 丙氨酸 赖氨 2020-05-17 …
已知角a的顶点在坐标原点,始边在x轴的正半轴上,P点在角a终边上,如果tana=2根号2,且P点横 2020-07-16 …
(1)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系正确的是(填序号,下同 2020-07-29 …
二阶微分方程题目为y"=1+(y’)^2.我的解法是:令P=y’,带入原方程得到P’=P^2+1.推 2020-10-31 …
已知关于x的二次方程x^2-2(p+1)x+p^2+8=0的两根之差的绝对值为2,则P的值是?详细点 2020-10-31 …
下面的CCS命名怎么转换成IUPAC命名5,5,5-三氯-3-戊烯-2-酮p-氯-苯丙酸苯酯4-磺酸 2020-11-10 …
二阶微分方程求解题目2xy''=y'令p=y',则y''=p'=>2xp'=p=>2*dp/p=dx 2020-11-16 …
某研究小组以甲苯为主要原料,采用以下路线合成肉桂酸甲酯P和医药中间体Q.已知:(1),-NH2易被强 2020-12-14 …
以致A(8,0)B(0,6)O为坐标原点求三角形AOB内切圆C的方程(2)设P是圆C上一点求P到直线 2021-01-13 …