早教吧作业答案频道 -->化学-->
葡萄酒常用Na2S2O5做抗氧化剂.(1)1.90gNa2S2O5最多能还原mLO2(标准状况).(2)0.5molNa2S2O5溶解于水配成1L溶液,该溶液pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图所示.写出Na2S2O
题目详情
葡萄酒常用Na2S2O5做抗氧化剂.
(1)1.90g Na2S2O5最多能还原___mLO2(标准状况).
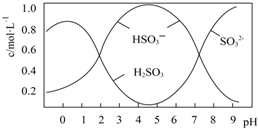
(2)0.5mol Na2S2O5溶解于水配成1L溶液,该溶液pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图所示.写出Na2S2O5溶解于水的化学方程式___;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是___;
已知:Ksp[BaSO4]=110-10,Ksp[BaSO3]=510-7.把部分被空气氧化的该溶液pH调为10,向溶液中滴加BaCl2使SO42-沉淀完全[c(SO42-)≤110-5mol•L-1],此时溶液中c(SO32-)≤___mol•L-
(3)葡萄酒样品中抗氧化剂的残留量测定(已知:SO2+I2+2H2O═H2SO4+2HI):
准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分.取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为0.0225mol•L-1标准I2溶液滴定至终点,消耗标准I2溶液16.02mL.重复以上操作,消耗标准I2溶液15.98mL.计算葡萄酒样品中抗氧化剂的残留量 (单位:mg•L-1,以SO2计算,请给出计算过程.)

(1)1.90g Na2S2O5最多能还原___mLO2(标准状况).
(2)0.5mol Na2S2O5溶解于水配成1L溶液,该溶液pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图所示.写出Na2S2O5溶解于水的化学方程式___;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是___;
已知:Ksp[BaSO4]=110-10,Ksp[BaSO3]=510-7.把部分被空气氧化的该溶液pH调为10,向溶液中滴加BaCl2使SO42-沉淀完全[c(SO42-)≤110-5mol•L-1],此时溶液中c(SO32-)≤___mol•L-
(3)葡萄酒样品中抗氧化剂的残留量测定(已知:SO2+I2+2H2O═H2SO4+2HI):
准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分.取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为0.0225mol•L-1标准I2溶液滴定至终点,消耗标准I2溶液16.02mL.重复以上操作,消耗标准I2溶液15.98mL.计算葡萄酒样品中抗氧化剂的残留量 (单位:mg•L-1,以SO2计算,请给出计算过程.)
▼优质解答
答案和解析
(1)在Na2S2O5与O2的反应中,硫从+4价升为+6价,氧从0价降为-2价,1.90g Na2S2O5的物质的量为0.01mol,根据电子得失守恒可知能还原氧气的物质的量为0.01mol,即标准状况224mL,
故答案为:224;
(2)根据图可知,pH=4.5时,溶液中主要以亚硫酸氢根离子形式存在,所以水解方程式为Na2S2O5+H2O=2NaHSO3,当溶液pH小于1后,溶液中主要以亚硫酸形成存在,但亚硫酸不稳定,易分解生成二氧化硫或亚硫酸被氧化也会导致浓度小,
根据Ksp[BaSO4]=c(Ba2+)•c(SO42-),可知需要c(Ba2+)=
=
=10-5mol•L-1,则溶液中SO32-的最大浓度c(SO32-)=
=
=0.05mol•L-1,
故答案为:Na2S2O5+H2O=2NaHSO3;亚硫酸不稳定,易分解生成二氧化硫,或亚硫酸被氧化;0.05;
(3)根据题意可知,消耗标准I2溶液的体积为
=16.0mL,所以I2的物质的量为16.0×10-3L×0.0225mol•L-1=3.6×10-4mol,根据反应SO2+I2+2H2O=H2SO4+2HI,可知二氧化硫的物质的量为3.6×10-4mol,SO2的质量为64g/mol×3.6×10-4mol=23.04mg,所以葡萄酒样品中抗氧化剂的残留量为
=230.4mg•L-1,答:残留量为230.4mg•L-1.
故答案为:224;
(2)根据图可知,pH=4.5时,溶液中主要以亚硫酸氢根离子形式存在,所以水解方程式为Na2S2O5+H2O=2NaHSO3,当溶液pH小于1后,溶液中主要以亚硫酸形成存在,但亚硫酸不稳定,易分解生成二氧化硫或亚硫酸被氧化也会导致浓度小,
根据Ksp[BaSO4]=c(Ba2+)•c(SO42-),可知需要c(Ba2+)=
| Ksp(BaSO4) | ||
c(S
|
| 1×10-10 |
| 1×10-5 |
| Ksp(BaSO3) |
| c(Ba2+) |
| 5×10-7 |
| 10-5 |
故答案为:Na2S2O5+H2O=2NaHSO3;亚硫酸不稳定,易分解生成二氧化硫,或亚硫酸被氧化;0.05;
(3)根据题意可知,消耗标准I2溶液的体积为
| 15.98mL+16.02mL |
| 2 |
| 23.04mg |
| 0.1L |
看了 葡萄酒常用Na2S2O5做抗...的网友还看了以下:
设NA为阿伏伽德罗常数的值,下列叙述正确的是()A.0.5L1mol/LNaHS溶液中,N(Na+ 2020-04-11 …
恒温蒸发M溶液经如下变化:蒸发10g水,无固体析出,得N溶液;把N溶液蒸发10g水,析出3g固体, 2020-05-02 …
以知盐溶液中,阳离子所带的正电荷总数等于阳离子所带负电荷总数.如NaCL溶液中:N(Na+)=N( 2020-05-13 …
溴和碘的各种溶液的颜色?见下:请问1溴的水溶液、2溴汽油溶液、3溴四氯化碳溶液,4溴的苯溶液,5溴 2020-05-17 …
直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.该方法中,Na2S 2020-07-08 …
25℃时,在下列给定条件的溶液中,一定能大量共存的离子组是()A.PH=1的溶液中:Fe2+、NO 2020-07-13 …
下列离子方程式书写正确的是()A.用惰性电极电解AgNO3溶液:Ag++2H2O═Ag↓+4H++ 2020-07-16 …
Na2SO3溶液做为吸收液吸收SO2时,吸收液pH随n(SO32-):n(HSO3-)变化的关系如 2020-07-29 …
电解质溶液中的守恒关系.电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷 2020-07-29 …
下列离子方程式书写不正确的是()A.NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3 2021-02-01 …