早教吧作业答案频道 -->化学-->
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:实验一焦亚硫酸钠的制取采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置II中有Na2S2O5晶体析出
题目详情
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置 II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
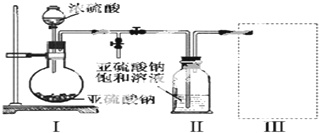
(1)装置 I中产生气体的化学方程式为___.
(2)要从装置 II中获得已析出的晶体,可采取的分离方法是___.
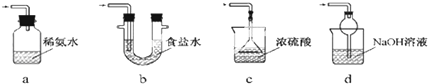
(3)装置 III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___(填序号).
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3.
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是___.
实验三 葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
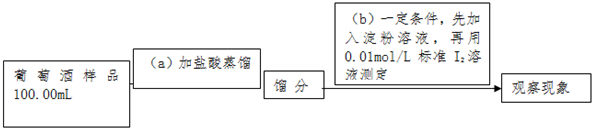
i:上述实验方案,(b)步操作的原理是:___,操作后应观察的现象是:___.
ii:按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为___g/L.
iii:在上述实验过程中,若有部分HI被空气氧化,则测定结果___(填“偏高”、“偏低”或“不变”)
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置 II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5

(1)装置 I中产生气体的化学方程式为___.
(2)要从装置 II中获得已析出的晶体,可采取的分离方法是___.
(3)装置 III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___(填序号).

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3.
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是___.
实验三 葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

i:上述实验方案,(b)步操作的原理是:___,操作后应观察的现象是:___.
ii:按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为___g/L.
iii:在上述实验过程中,若有部分HI被空气氧化,则测定结果___(填“偏高”、“偏低”或“不变”)
▼优质解答
答案和解析
(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离,
故答案为:过滤;
(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d;
(4)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成;
(5)①当滴入最后一滴I2溶液时,溶液从无色恰好变为蓝色,且30秒内不褪色;二氧化硫具有还原性、碘具有氧化性,二者在水溶液中发生反应SO2+I2+2H2O═H2SO4+2HI,
上述实验方案,(b)步操作的原理是SO2+I2+2H2O═H2SO4+2HI,操作后应观察的现象是滴入最后一滴I2溶液时,溶液从无色恰好变为蓝色,且30秒内不褪色,
故答案为:SO2+I2+2H2O═H2SO4+2HI;滴入最后一滴I2溶液时,溶液从无色恰好变为蓝色,且30秒内不褪色;
②令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.025L×0.01mol/L
所以,64g:mg=1mol:0.025L×0.01mol/L,
解得m=0.016
故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
=0.16 g/L
故答案为:0.16;
③若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低,
故答案为:偏低.
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离,
故答案为:过滤;
(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d;
(4)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成;
(5)①当滴入最后一滴I2溶液时,溶液从无色恰好变为蓝色,且30秒内不褪色;二氧化硫具有还原性、碘具有氧化性,二者在水溶液中发生反应SO2+I2+2H2O═H2SO4+2HI,
上述实验方案,(b)步操作的原理是SO2+I2+2H2O═H2SO4+2HI,操作后应观察的现象是滴入最后一滴I2溶液时,溶液从无色恰好变为蓝色,且30秒内不褪色,
故答案为:SO2+I2+2H2O═H2SO4+2HI;滴入最后一滴I2溶液时,溶液从无色恰好变为蓝色,且30秒内不褪色;
②令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.025L×0.01mol/L
所以,64g:mg=1mol:0.025L×0.01mol/L,
解得m=0.016
故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
| 0.016g |
| 0.1L |
故答案为:0.16;
③若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低,
故答案为:偏低.
看了 焦亚硫酸钠(Na2S2O5)...的网友还看了以下:
实验室常用浓硫酸和乙醇混合加热制取乙烯.请填写下列空白:(1)实验室制乙烯的化学方程式为.(2实验 2020-04-08 …
怎样鉴别强酸弱酸?两瓶PH=2的酸溶液,一瓶是强酸,一瓶是弱酸.提供实验室常用的试剂和指示剂,请说 2020-05-13 …
一道时间复杂度的题...没方向,求详解...急已知有实现同一功能的两个算法,其时间复杂度分别为O( 2020-06-08 …
实验室化学科学的基础,在实验室中不慎受碱腐蚀时,可先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液冲 2020-07-07 …
(1/2)实验结束时,同学们将含有硫酸铜、硫酸锌、硫酸亚铁、的废液倒在废液缸里,如果将废液直接排放 2020-07-14 …
怎么用化学实验证明硫酸是2元酸啊请详细分别说出怎样用1滴定法2收集气体的方法证明硫酸是2元酸 2020-11-30 …
定氮过程中有个2%硼酸溶液的配制如何配制2%硼酸溶液,他的PH=6,或4.5对结果有什么影响?在实际 2020-12-02 …
1.若集合A={x|(a-1)x^2+2x+1=o}中只含有一个元素,求实数a2.已知集合A={1, 2020-12-07 …
1.实验室需要配置500ml0.4mol/L的Na2CO3溶液,现用Na2CO3•10H2O需称取几 2021-02-01 …
(1)化学符号表示:①两个硫酸根离子.②两个亚铁离子③氧化镁中镁元素的化合价为+2价+2MgO+2M 2021-02-18 …