早教吧作业答案频道 -->化学-->
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域.(1)基态氮原子的核外电子排布式为.(2)与N-3互为等电
题目详情
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域.
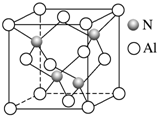
(1)基态氮原子的核外电子排布式为___.
(2)与N
互为等电子体的离子有___(任写一种).工业上用氧化铝与氮气和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,其化学式为___,工业制备X的化学方程式为___.
(3)X晶体中包含的化学键类型为___(填字母).
A.共价键 B.配位键 C.离子键 D.金属键
X晶体中氮原子的杂化类型为___杂化.
(4)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是___.
(5)若X的密度为ρ g•cm-3,则晶体中最近的两个Al原子的距离为___ cm.(阿伏加德罗常数的值用NA表示)

(1)基态氮原子的核外电子排布式为___.
(2)与N
| - 3 |
(3)X晶体中包含的化学键类型为___(填字母).
A.共价键 B.配位键 C.离子键 D.金属键
X晶体中氮原子的杂化类型为___杂化.
(4)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是___.
(5)若X的密度为ρ g•cm-3,则晶体中最近的两个Al原子的距离为___ cm.(阿伏加德罗常数的值用NA表示)
▼优质解答
答案和解析
(1)氮元素原子核外电子数为7,核外电子排布式为:1s22s22p3,
故答案为:1s22s22p3;
(2)原子数目相等、价电子总数也相等的微粒互为等电子体,与N3-互为等电子体的离子有SCN-等,
根据X的晶体结构图可知,晶胞中含有氮原子为4,含有铝原子8×
+6×
=4,所以X的化学式为AlN,根据元素守恒可以写出化学方程式为Al2O3+N2+3C=2AlN+3CO,
故答案为:SCN-;Al2O3+N2+3C=2AlN+3CO;
(3)N原子与周围的4个Al原子中之间形成4个共价键,晶体中Al、N原子数目之比为1:1,则Al原子与周围的4个N原子也形成4个共价键,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,所以在AlN中有配位键;N原子没有孤对电子,杂化轨道数目为4,N原子杂化方式为sp3杂化,
故答案为:AB;sp3;
(4)氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B-N键键能大于Al-N键键能,故氮化硼的熔点较高,
故答案为:氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B-N键键能大于Al-N键键能;
(5)晶胞中面心对角线上的原子距离最近,晶胞质量为4×
g,设晶胞棱长为x cm,则
4×
g=ρ g•cm-3×(x cm)3,解得x=
,故最近的两个Al原子的距离为
×
cm,
故答案为:
×
.
故答案为:1s22s22p3;
(2)原子数目相等、价电子总数也相等的微粒互为等电子体,与N3-互为等电子体的离子有SCN-等,
根据X的晶体结构图可知,晶胞中含有氮原子为4,含有铝原子8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:SCN-;Al2O3+N2+3C=2AlN+3CO;
(3)N原子与周围的4个Al原子中之间形成4个共价键,晶体中Al、N原子数目之比为1:1,则Al原子与周围的4个N原子也形成4个共价键,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,所以在AlN中有配位键;N原子没有孤对电子,杂化轨道数目为4,N原子杂化方式为sp3杂化,
故答案为:AB;sp3;
(4)氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B-N键键能大于Al-N键键能,故氮化硼的熔点较高,
故答案为:氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B-N键键能大于Al-N键键能;
(5)晶胞中面心对角线上的原子距离最近,晶胞质量为4×
| 27+14 |
| NA |
4×
| 27+14 |
| NA |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
故答案为:
| ||
| 2 |
| 3 |
| ||
看了 某氮铝化合物X具有耐高温、抗...的网友还看了以下:
选做题--物质结构与性质某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领 2020-04-09 …
物质的性质决定物质的用途.下列因果关系不成立的是()A.因为氧气能支持燃烧,所以可用作燃料B.因为 2020-04-11 …
何为不良地基?何为不良地质条件?1,何为不良地基?何为不良地质条件?2,不良地基和软弱地基有何共同 2020-05-17 …
嫁接可克服种子繁殖不能保存亲代优良品质的缺点。()A.正确B.错误 2020-05-25 …
描写优良品质的词有哪些?越多越好词语 2020-06-05 …
求一个有关陶渊明的议论文的例子?高中的作文.简述陶渊明优良品质的就可以,最好开头附诗 2020-06-09 …
成语大搜索寻找成语.请听题:1.含有近义词的:2.含有反义词的:3.含有数字的:4.含有动物的:5 2020-06-10 …
氮化铝(AIN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于大规模集成电路生产、陶瓷工业等 2020-06-19 …
表示一个人不怕苦难,很坚强,具优良品质的成语或词语、或者语句、谢喽 2020-06-22 …
“他是一位达到了伟大境界而仍能保持自己优良品质的罕有的人物……以至于只有在他成为殉难者倒下去之后, 2020-06-29 …