早教吧作业答案频道 -->化学-->
黄铜矿(CuFeS2)是冶炼铜及制备铁氧化物的重要矿藏,常含微量的金、银等.右图是以黄铜矿为主要原料生产铜、铁红(氧化铁)颜料的工艺流程图:(1)CuFeS2中,Fe的化合价为.(2)写
题目详情
黄铜矿(CuFeS2)是冶炼铜及制备铁氧化物的重要矿藏,常含微量的金、银等.右图是以黄铜矿为主要原料生产铜、铁红(氧化铁)颜料的工艺流程图:
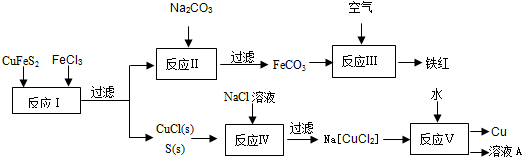
(1)CuFeS2中,Fe的化合价为___.
(2)写出“反应Ⅰ”的离子方程式___,该反应的氧化剂是___.
(3)CuCl难溶于水,但可与过量的Cl-反应生成溶于水的[CuCl2]-.该反应的离子方程式为___.
(4)反应Ⅰ~V五个反应中属于非氧化还原反应的是反应___(选填“Ⅰ~V”).
(5)已知Cu+在反应V中发生自身氧化还原反应,歧化为C u2+和Cu,由此可推知“溶液A”中的溶质为___(写出化学式).
(6)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为___
(7)将一定量的铁红溶于160mL 5mol•L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为___.

(1)CuFeS2中,Fe的化合价为___.
(2)写出“反应Ⅰ”的离子方程式___,该反应的氧化剂是___.
(3)CuCl难溶于水,但可与过量的Cl-反应生成溶于水的[CuCl2]-.该反应的离子方程式为___.
(4)反应Ⅰ~V五个反应中属于非氧化还原反应的是反应___(选填“Ⅰ~V”).
(5)已知Cu+在反应V中发生自身氧化还原反应,歧化为C u2+和Cu,由此可推知“溶液A”中的溶质为___(写出化学式).
(6)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为___
(7)将一定量的铁红溶于160mL 5mol•L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为___.
▼优质解答
答案和解析
氯化铁具有氧化性,能氧化黄铜矿,根据产物知反应I为CuFeS2+3Fe3++Cl-=4Fe2++CuCl↓+2S↓,然后过滤得到固体CuCl和S和滤液,向滤液中加入碳酸钠发生反应II,发生的离子反应方程式为Fe2++CO32-=FeCO3↓,过滤得到FeCO3,在空气中灼烧FeCO3得到氧化铁,反应III为4FeCO3+O2
2Fe2O3+4CO2;
向CuCl、S的混合物中加入NaCl溶液,发生反应IV为Cl-+CuCl=[CuCl2]-,过滤得到Na[CuCl2],再加入水发生反应V生成Cu和溶液A,Cu+在反应V中发生自身氧化还原反应,歧化为C u2+和Cu,则A为CuCl2、NaCl,
(1)CuFeS2中S为-2价、Cu为+2价,Fe的化合价为+2价,故答案为:+2;
(2)反应I的离子方程式为CuFeS2+3Fe3++Cl-=4Fe2++CuCl↓+2S↓,该反应中FeCl3、CuFeS2都得电子,所以CuFeS2、FeCl3都作氧化剂,
故答案为:CuFeS2+3Fe3++Cl-=4Fe2++CuCl↓+2S↓;CuFeS2、FeCl3;
(3)该反应离子方程式为Cl-+CuCl=[CuCl2]-,故答案为:Cl-+CuCl=[CuCl2]-;
(4)这些反应中只有II和IV为非氧化还原反应,故答案为:Ⅱ、Ⅳ;
(5)反应Ⅴ为Na[CuCl2]和H2O的反应,根据题给信息知生成物是Cu、NaCl和CuCl2,所得的溶液中的溶质是CuCl2、NaCl,故答案为:CuCl2、NaCl;
(6)在酸性溶液中利用氧气可以将黄铜矿氧化成硫酸盐,则应有硫酸参加反应,且生成硫酸铜,硫酸铁和水,反应的方程式为4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O,离子反应方程式为:4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O,
故答案为:4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O;
(7)氢气的物质的量为
=0.1mol,
Fe~~~~2HCl~~~H2,
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为
×(0.16L×5mol/L-0.2mol)=0.2mol,
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g/mol=11.2g,
故答案为:11.2g.
| ||
向CuCl、S的混合物中加入NaCl溶液,发生反应IV为Cl-+CuCl=[CuCl2]-,过滤得到Na[CuCl2],再加入水发生反应V生成Cu和溶液A,Cu+在反应V中发生自身氧化还原反应,歧化为C u2+和Cu,则A为CuCl2、NaCl,
(1)CuFeS2中S为-2价、Cu为+2价,Fe的化合价为+2价,故答案为:+2;
(2)反应I的离子方程式为CuFeS2+3Fe3++Cl-=4Fe2++CuCl↓+2S↓,该反应中FeCl3、CuFeS2都得电子,所以CuFeS2、FeCl3都作氧化剂,
故答案为:CuFeS2+3Fe3++Cl-=4Fe2++CuCl↓+2S↓;CuFeS2、FeCl3;
(3)该反应离子方程式为Cl-+CuCl=[CuCl2]-,故答案为:Cl-+CuCl=[CuCl2]-;
(4)这些反应中只有II和IV为非氧化还原反应,故答案为:Ⅱ、Ⅳ;
(5)反应Ⅴ为Na[CuCl2]和H2O的反应,根据题给信息知生成物是Cu、NaCl和CuCl2,所得的溶液中的溶质是CuCl2、NaCl,故答案为:CuCl2、NaCl;
(6)在酸性溶液中利用氧气可以将黄铜矿氧化成硫酸盐,则应有硫酸参加反应,且生成硫酸铜,硫酸铁和水,反应的方程式为4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O,离子反应方程式为:4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O,
故答案为:4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42-+2H2O;
(7)氢气的物质的量为
| 2.24L |
| 22.4L/mol |
Fe~~~~2HCl~~~H2,
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为
| 1 |
| 2 |
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g/mol=11.2g,
故答案为:11.2g.
看了 黄铜矿(CuFeS2)是冶炼...的网友还看了以下:
黄铜矿CuFeS2可用于冶炼铜,冶炼原理为:2CuFeS2+2SiO2+5O2=2Cu+2FeSi 2020-05-13 …
生产生活中广泛涉及氧化还原反应.(1)工业上冶炼下列物质通常不采用电解法的是.a.Nab.Mgc. 2020-06-27 …
工业上金属铜的冶炼常用黄铜矿为原料,黄酮矿在焙烧过程中发生的主要反应的化方程式为①2CuFeS2+ 2020-07-06 …
已知冰铜的化学式为mCu2S•nFeS,可由Cu2S和FeS互相熔合而成,为工业上冶炼铜的中间产物 2020-07-06 …
工业上可采用多种方法冶炼铜.(1)在地下利用爆破粉碎孔雀石[Cu2(OH)2CO3],再注入稀硫酸 2020-07-08 …
下列各项不属于中国古代手工业发展特征的是()A.产品供国内、国外消费的需要B.手工业生产长期领先于 2020-07-10 …
由黄铜矿(主要成分是CuFeS2)可以冶炼得到粗铜,再经过电解精炼得到纯铜.(1)黄铜矿冶炼得到粗 2020-07-14 …
工业上用黄铜矿冶炼铜及对炉渣综合利用的一种工艺流程如下:(1)冶炼过程中得到Cu2O和Cu的混合物 2020-07-14 …
铜、铝、硫及其它们的化合物应用广泛,如Cu可用作催化剂、制作印刷电路铜板等.Ⅰ.铜的冶炼:工业上以辉 2020-11-22 …
下列有关冶炼金属的说法正确的是()A.工业上冶炼钠,是通过电解氯化钠饱和溶液B.工业上冶炼铝,如果以 2021-02-05 …