早教吧作业答案频道 -->化学-->
氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁.实验室制备装置和工业制备流程图如图:已知:(1)无水FeCl3的熔点为555K、沸点为588K.(2)废铁屑中的杂质不与盐酸反应(3)不
题目详情
氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁.实验室制备装置和工业制备
流程图如图:
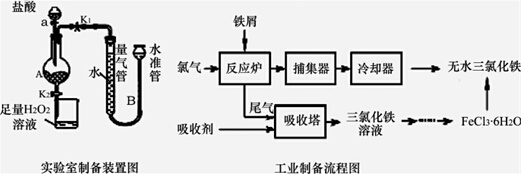
已知:(1)无水FeCl3的熔点为555K、沸点为588K.(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3•6H2O晶体.请回答:
(1)烧杯中足量的H2O2溶液的作用是___.
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是___.
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入___后、___、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:___.
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为___.
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-).
①滴定终点的现象是:___;
②样品中氯化铁的质量分数___.
流程图如图:

已知:(1)无水FeCl3的熔点为555K、沸点为588K.(2)废铁屑中的杂质不与盐酸反应
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸.
Ⅱ.当…时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3•6H2O晶体.请回答:
(1)烧杯中足量的H2O2溶液的作用是___.
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是___.
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入___后、___、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式:___.
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为___.
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1Na2S2O3溶液滴定,消耗VmL(已知:I2+2S2O32-═2I-+S4O62-).
①滴定终点的现象是:___;
②样品中氯化铁的质量分数___.
▼优质解答
答案和解析
(1)根据实验装置和操作步骤可知,实验室制备无水FeCl3,是利用铁与盐酸反应生成FeCl2,然后把FeCl2氧化成FeCl3,先制得FeCl3•6H2O晶体,再脱结晶水制得无水FeCl3.烧杯中足量的H2O2溶液是作氧化剂,把亚铁离子全部氧化成三价铁离子;
故答案为:把亚铁离子全部氧化成三价铁离子;
(2)铁与盐酸反应完全时,不再产生氢气,所以装置A中不产生气泡或量气管和水准管的液面不再变化,此时,可将A中FeCl2溶液放入烧杯中进行氧化;
故答案为:装置A中不产生气泡或量气管和水准管液面不变(其他合理答案也给分);
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
故答案为:盐酸;蒸发浓缩、冷却结晶;
(4)从工业制备流程图分析可知,反应炉中进行的反应是 2Fe+3Cl2=2FeCl3,因此,进入吸收塔中的尾气是没有参加反应的氯气,在吸收塔中氯气被吸收剂吸收,反应后生成2FeCl3溶液,所以吸收剂应是2FeCl2溶液,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(5)捕集器收集的是气态FeCl3,FeCl3的相对分子质量是162.5,由相对分子质量为325的铁的氯化物可以推出,当温度超过673K时,二分子气态FeCl3可以聚合生成双聚体Fe2Cl6,
故答案为:Fe2Cl6;
(6)①称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,此时溶液呈蓝色,用 Na2S2O3溶液滴定,滴入最后一滴Na2S2O3溶液,锥形瓶内的溶液由蓝色变为无色,且半分钟内不变色.所以滴定终点的现象是:溶液由蓝色变为无色,且半分钟内不变色,
故答案为:溶液由蓝色变无色,且半分钟内不变色;
②由反应:2Fe3++2I -=2Fe2++I2; I2+2S2O32-═2I-+S4O62-;可得关系式:
2Fe3+-I2-2S2O32-
1 1
n cV×10-3
求得n(Fe3+)=cV×10-3mol,则样品中氯化铁的质量分数为:
ω(Fe3+)=cV×10-3mol×10×162.5g/mol×100%=
%,
故答案为:
%.
故答案为:把亚铁离子全部氧化成三价铁离子;
(2)铁与盐酸反应完全时,不再产生氢气,所以装置A中不产生气泡或量气管和水准管的液面不再变化,此时,可将A中FeCl2溶液放入烧杯中进行氧化;
故答案为:装置A中不产生气泡或量气管和水准管液面不变(其他合理答案也给分);
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
故答案为:盐酸;蒸发浓缩、冷却结晶;
(4)从工业制备流程图分析可知,反应炉中进行的反应是 2Fe+3Cl2=2FeCl3,因此,进入吸收塔中的尾气是没有参加反应的氯气,在吸收塔中氯气被吸收剂吸收,反应后生成2FeCl3溶液,所以吸收剂应是2FeCl2溶液,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(5)捕集器收集的是气态FeCl3,FeCl3的相对分子质量是162.5,由相对分子质量为325的铁的氯化物可以推出,当温度超过673K时,二分子气态FeCl3可以聚合生成双聚体Fe2Cl6,
故答案为:Fe2Cl6;
(6)①称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,此时溶液呈蓝色,用 Na2S2O3溶液滴定,滴入最后一滴Na2S2O3溶液,锥形瓶内的溶液由蓝色变为无色,且半分钟内不变色.所以滴定终点的现象是:溶液由蓝色变为无色,且半分钟内不变色,
故答案为:溶液由蓝色变无色,且半分钟内不变色;
②由反应:2Fe3++2I -=2Fe2++I2; I2+2S2O32-═2I-+S4O62-;可得关系式:
2Fe3+-I2-2S2O32-
1 1
n cV×10-3
求得n(Fe3+)=cV×10-3mol,则样品中氯化铁的质量分数为:
ω(Fe3+)=cV×10-3mol×10×162.5g/mol×100%=
| 162.5cV |
| m |
故答案为:
| 162.5cV |
| m |
看了 氯化铁是常见的水处理剂,利用...的网友还看了以下:
建筑工地有一大一小二个水池,用同样的输水管给2个水池注水,大水池需要6小时注满小水池需4小时注满. 2020-04-26 …
一个水池,水管应用题一个水池,现有1/6池水.水池有4个水管,甲为注水管,3小时能将水池注满,乙为 2020-05-05 …
某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金 2020-05-13 …
酸过多是常见的胃瘸.下面是甲、乙两种常见胃药的说明摘要甲:(1)白色结晶状粉末,可缓缓分解;(2) 2020-06-23 …
老僧三十年前未参禅时,见山是山,见水是水.及至后来,亲见知识,有个入处,见山是山,见水是水.及至后 2020-07-01 …
某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金 2020-07-16 …
某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属 2020-11-30 …
“井底之蛙”这个成语常被用来讽剌没有见识的人,现有井口大小和深度完全相同两口井,一口是枯井,一口井里 2020-12-10 …
一、在你居住的城市中,你看见过海市蜃楼吗?炎热的夏日,当你沿着沥青路面行走时,会发现前方出现一大片水 2020-12-23 …
一位禅师说:“老僧三十年前未参禅时,见山是山,见水是水。及至后来,亲见知识,有个入处,见山不是山,见 2021-01-16 …