早教吧作业答案频道 -->化学-->
氢气最有可能成为21世纪的主要能源,但氢气需要由其他物质来制备.制氢的方法之一是以煤的转化为基础,其基本原理是用碳、水在气化炉中发生如下反应:C(s)+H2O(g)⇌CO(g)+H2(g)
题目详情
氢气最有可能成为21世纪的主要能源,但氢气需要由其他物质来制备.制氢的方法之一是以煤的转化为基础,其基本原理是用碳、水在气化炉中发生如下反应:
C(s)+H2O(g)⇌CO(g)+H2(g)△H1=+131.3kJ•mol-1
CO(g)+H2O(g)⇌CO2(g)+H2(g)△H2
(1)已知1molH-H、O-H、C=O、C≡O化学键断裂时分别需要吸收436kJ、458.5kJ、799kJ、1076kJ的能量,则△H2=___.
产物中的H2与平衡体系中的C、CO2继续发生如下反应,可生成甲烷.
C(s)+2H2(g)⇌CH4(g)△H3=-74.8kJ•mol-1
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H4,则△H4=___.
(2)在1L容积固定的密闭容器中投入1.8molCH4和3.6molH2O(g),若只发生反应:CH4(g)+2H2O(g)⇌CO2(g)+4H2(g),测得CH4、H2O(g)及某一生成物X的物质的量浓度(c)随反应时间(t)的变化如图1所示,第9min前H2O(g)的物质的理浓度及第4min~9min之间X所代表生成物的物质的量浓度变化曲线未标出,条件有变化时只考虑一个条件.
①0~4min内,H2的平均反应速率v(H2)=___mol•L-1•min-1.
②以上反应在第5min时的平衡常数K=___.(计算结果保留两位小数)
③第6min时改变的条件是___.
(3)用甲烷做燃料电池电解CuSO4溶液、FeCO3和FeCl2混合液的示意图如图2所示,其中A、B、D均为石墨电极、C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同(相同条件下).
①甲中通入O2的一极为___极(填“正”或“负”),通入甲烷一极的电极反应式为___.
②乙中A极析出的气体在标准状况下的体积为___L.
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图3所示,则图中③线表示的是___(填离子符号)的变化;原溶液中c(Fe2+)=___.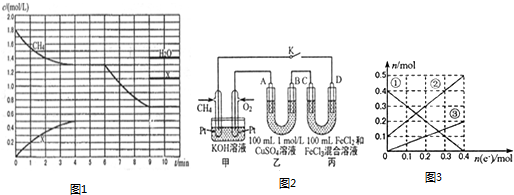
C(s)+H2O(g)⇌CO(g)+H2(g)△H1=+131.3kJ•mol-1
CO(g)+H2O(g)⇌CO2(g)+H2(g)△H2
(1)已知1molH-H、O-H、C=O、C≡O化学键断裂时分别需要吸收436kJ、458.5kJ、799kJ、1076kJ的能量,则△H2=___.
产物中的H2与平衡体系中的C、CO2继续发生如下反应,可生成甲烷.
C(s)+2H2(g)⇌CH4(g)△H3=-74.8kJ•mol-1
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H4,则△H4=___.
(2)在1L容积固定的密闭容器中投入1.8molCH4和3.6molH2O(g),若只发生反应:CH4(g)+2H2O(g)⇌CO2(g)+4H2(g),测得CH4、H2O(g)及某一生成物X的物质的量浓度(c)随反应时间(t)的变化如图1所示,第9min前H2O(g)的物质的理浓度及第4min~9min之间X所代表生成物的物质的量浓度变化曲线未标出,条件有变化时只考虑一个条件.
①0~4min内,H2的平均反应速率v(H2)=___mol•L-1•min-1.
②以上反应在第5min时的平衡常数K=___.(计算结果保留两位小数)
③第6min时改变的条件是___.
(3)用甲烷做燃料电池电解CuSO4溶液、FeCO3和FeCl2混合液的示意图如图2所示,其中A、B、D均为石墨电极、C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同(相同条件下).
①甲中通入O2的一极为___极(填“正”或“负”),通入甲烷一极的电极反应式为___.
②乙中A极析出的气体在标准状况下的体积为___L.
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图3所示,则图中③线表示的是___(填离子符号)的变化;原溶液中c(Fe2+)=___.

▼优质解答
答案和解析
(1)已知1molH-H、O-H、C=O、C≡O化学键断裂时分别需要吸收436kJ、458.5kJ、799kJ、1076kJ的能量,则△H2=1076kJ/mol+2×458.5kJ/mol-2×799kJ/mol-436kJ/mol=-41kJ/mol;
由①C(s)+H2O(g)⇌CO(g)+H2(g)△H1=+131.3kJ•mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g)△H2=-41kJ/mol
③C(s)+2H2(g)⇌CH4(g)△H3=-74.8kJ•mol-1
结合盖斯定律③-①-②得到CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H4,则△H4=-165.1kJ/mol,
故答案为:-41kJ/mol;-165.1kJ/mol;
(2)根据图象0-4min甲烷减少0.5mol/L,X增加0.5mol/L,则X为二氧化碳,4-6min为平衡状态,
CH4(g)+2H2O(g)═CO2(g)+4H2(g)
开始 1.8 3.6 0 0
转化 0.5 1 0.5 2
平衡 1.3 2.6 0.5 2
①0~4min内,H2的平均反应速率υ(H2)=
=0.5mol•L-1•min-1,
故答案为:0.5;
②反应在5min时的平衡常数K=
=0.91,
故答案为:0.91;
③根据图象第6 min~9 min时的反应速率比0~4 min时的大,且平衡向正反应方向移动,说明第6 min改变的条件为升高温度或增加水蒸气的量,再根据第9 min平衡时甲烷浓度为0.7 mol/L,水蒸气浓度为1.4 mol/L,说明甲烷消耗1.1 mol,水蒸气消耗2.2 mol,所以不可能为增加水蒸气的量,因此改变的条件只可能为升高温度,
故答案为:升高温度;
(3)①甲中通入O2的一极发生还原反应为正极;负极发生氧化反应,甲烷在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应为:CH4-8e-+10OH-=CO32-+7H2O,
故答案为:正;CH4-8e-+10OH-=CO32-+7H2O;
②乙为电解池,A为阳极、B为阴极,A电极生成气体为氧气,B电极先析出Cu,而后生成气体为氢气,析出Cu的物质的量为0.1L×1mol/L=0.1mol,设氧气、氢气的物质的量均为n mol,根据电子转移守恒:4n=2n+0.1×2,解得n=0.1,故A极析出的氧气在标准状况下的体积为0.1mol×22.4L/mol=2.24L,
故答案为:2.24L;
③根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,①为Fe3+,②为Fe2+,③为Cu2+,
依据②计算得到电子转移为0.2mol,当电子转移为0.2mol时,丙中阳极电极反应Cu-2e-=Cu2+,生成Cu2+物质的量为0.1mol,图象分析每个单位为0.05mol,阴极电极反应Fe3++e-=Fe2+,原溶液中有Fe2+ 0.1mol,所以原溶液中c(Fe2+)=
=1mol/L,
故答案为:Cu2+;1mol/L.
由①C(s)+H2O(g)⇌CO(g)+H2(g)△H1=+131.3kJ•mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g)△H2=-41kJ/mol
③C(s)+2H2(g)⇌CH4(g)△H3=-74.8kJ•mol-1
结合盖斯定律③-①-②得到CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H4,则△H4=-165.1kJ/mol,
故答案为:-41kJ/mol;-165.1kJ/mol;
(2)根据图象0-4min甲烷减少0.5mol/L,X增加0.5mol/L,则X为二氧化碳,4-6min为平衡状态,
CH4(g)+2H2O(g)═CO2(g)+4H2(g)
开始 1.8 3.6 0 0
转化 0.5 1 0.5 2
平衡 1.3 2.6 0.5 2
①0~4min内,H2的平均反应速率υ(H2)=
| 2mol/L |
| 4min |
故答案为:0.5;
②反应在5min时的平衡常数K=
| 0.5×24 |
| 1.3×2.62 |
故答案为:0.91;
③根据图象第6 min~9 min时的反应速率比0~4 min时的大,且平衡向正反应方向移动,说明第6 min改变的条件为升高温度或增加水蒸气的量,再根据第9 min平衡时甲烷浓度为0.7 mol/L,水蒸气浓度为1.4 mol/L,说明甲烷消耗1.1 mol,水蒸气消耗2.2 mol,所以不可能为增加水蒸气的量,因此改变的条件只可能为升高温度,
故答案为:升高温度;
(3)①甲中通入O2的一极发生还原反应为正极;负极发生氧化反应,甲烷在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应为:CH4-8e-+10OH-=CO32-+7H2O,
故答案为:正;CH4-8e-+10OH-=CO32-+7H2O;
②乙为电解池,A为阳极、B为阴极,A电极生成气体为氧气,B电极先析出Cu,而后生成气体为氢气,析出Cu的物质的量为0.1L×1mol/L=0.1mol,设氧气、氢气的物质的量均为n mol,根据电子转移守恒:4n=2n+0.1×2,解得n=0.1,故A极析出的氧气在标准状况下的体积为0.1mol×22.4L/mol=2.24L,
故答案为:2.24L;
③根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,①为Fe3+,②为Fe2+,③为Cu2+,
依据②计算得到电子转移为0.2mol,当电子转移为0.2mol时,丙中阳极电极反应Cu-2e-=Cu2+,生成Cu2+物质的量为0.1mol,图象分析每个单位为0.05mol,阴极电极反应Fe3++e-=Fe2+,原溶液中有Fe2+ 0.1mol,所以原溶液中c(Fe2+)=
| 0.1mol |
| 0.1L |
故答案为:Cu2+;1mol/L.
看了 氢气最有可能成为21世纪的主...的网友还看了以下:
XXX的化合价是多少要怎么表达如题:水(H2O)中的O的化合价是答案是直接写-2呢还是写上H2O并在 2020-03-30 …
下列说法正确的是()A、NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心B、H2O 2020-04-11 …
关于化学式为[TiCl(H2O)5]Cl2•H2O的配合物的下列说法中正确的是()A.配位体是Cl 2020-05-13 …
关于化学式[TiCl(H2O)5]Cl2•H2O的配合物的下列说法中正确的是()A.配位体是Cl- 2020-05-13 …
关于化学式[TiCl(H2O)5]Cl2•H2O的配合物的下列说法中正确的是()A.配位体是Cl- 2020-05-13 …
下列关于生命的物质基础的叙述中,正确的是()A.多聚体彻底水解后的产物一定是它的单体B.脂肪彻底氧 2020-05-13 …
有机物A满足下列条件.①在空气中完全燃烧的产物是CO2和H2O,且燃烧过程中产生CO2的物质的量等 2020-05-14 …
有关化学电源方面的问题1.密闭的化学电源中电极反应能不能生成气体?2.心脏起搏器以Pt和Zn为电极 2020-05-20 …
乙醇不完全燃烧,求产物CO质量乙醇在氧气不充足条件下不完全燃烧,其产物中含有CO,CO2,H2O三 2020-05-22 …
有关高锰酸钾参与的某个反应如下:KMnO4+KI+H2SO4MnSO4+I2+KIO3+K2SO4 2020-06-14 …