早教吧作业答案频道 -->化学-->
某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol•L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半
题目详情
某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol•L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)
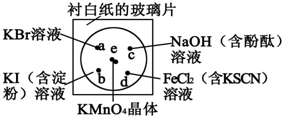
(1)实验室制备Cl2的离子方程式为______.该反应中发生反应的氧化剂和还原剂的物质的量之比为___.
(2)b处的实验现象___,d处的实验现象___.
(3)标准状况下,当有0.224L Cl2被NaOH溶液吸收后,转移电子的物质的量为___mol.
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?___(填“能”或“不能”),若能,其氧化性由强到弱的顺序是___.

(1)实验室制备Cl2的离子方程式为______.该反应中发生反应的氧化剂和还原剂的物质的量之比为___.
(2)b处的实验现象___,d处的实验现象___.
(3)标准状况下,当有0.224L Cl2被NaOH溶液吸收后,转移电子的物质的量为___mol.
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?___(填“能”或“不能”),若能,其氧化性由强到弱的顺序是___.
▼优质解答
答案和解析
(1)二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气和水,方程式:MnO2+4HCl(浓)
Mn2++Cl2↑+2H2O,离子方程式:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
依据方程式MnO2+4HCl(浓)
Mn2++Cl2↑+2H2O,二氧化锰做氧化剂,氯化氢做还原剂,消耗1mol二氧化锰,反应掉4mol氯化氢,其中有2mol做还原剂,所以氧化剂和还原剂的物质的量之比为1:2;
故答案为:MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O;1:2;
(2)氯气氧化性强于碘,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝;氯气氧化性强于三价铁离子,能够氧化二价铁离子生成三价铁离子,所以溶液由浅绿色变为红色;
故答案为:溶液由无色变为蓝色;溶液由浅绿色变为红色;
(3)标准状况下,当有0.224L Cl2被NaOH溶液吸收后,氯气物质的量=
=0.01mol,反应为Cl2+2NaOH=NaCl+NaClO+H2O,氯元素化合价0价变化为-1价和+1价,1mol氯气反应电子转移1mol,0.01mol氯气反应电子转移0.01mol,
故答案为:0.01;
(4)氧化还原反应中氧化剂氧化性强于氧化产物的氧化性.
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,高锰酸钾为氧化剂,氯气为氧化产物,所以氧化性:KMnO4>Cl2;氯气与二价铁离子反应生成三价铁离子,则氧化性:Cl2>FeCl3;
所以氧化性顺序为:KMnO4>Cl2>FeCl3;
故答案为:能;KMnO4>Cl2>FeCl3;
| ||
| ||
依据方程式MnO2+4HCl(浓)
| ||
故答案为:MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O;1:2;
(2)氯气氧化性强于碘,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝;氯气氧化性强于三价铁离子,能够氧化二价铁离子生成三价铁离子,所以溶液由浅绿色变为红色;
故答案为:溶液由无色变为蓝色;溶液由浅绿色变为红色;
(3)标准状况下,当有0.224L Cl2被NaOH溶液吸收后,氯气物质的量=
| 0.224L |
| 22.4L/mol |
故答案为:0.01;
(4)氧化还原反应中氧化剂氧化性强于氧化产物的氧化性.
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,高锰酸钾为氧化剂,氯气为氧化产物,所以氧化性:KMnO4>Cl2;氯气与二价铁离子反应生成三价铁离子,则氧化性:Cl2>FeCl3;
所以氧化性顺序为:KMnO4>Cl2>FeCl3;
故答案为:能;KMnO4>Cl2>FeCl3;
看了 某学生按下列操作做一个实验:...的网友还看了以下:
元素X是Y的同位素,都具有放射性,分别进行以下的衰变过程:,则下列说法正确的是()A.Q与S不再是 2020-04-05 …
高中电磁感应中n匝线圈的电阻的计算问题比如给你长度粗细相等的电阻丝,绕城N1N2圈半径r1r2,( 2020-04-12 …
四个半径为R的球两两相切,在四球形成的间隙中放入一个半径为r的球使之与另外四球均相切,求R与r关系 2020-04-27 …
与人交往要讲究艺术,也要讲究技巧。下列不能体现正确交往技巧的有()①与同学谈话时,小红总是心不在焉 2020-05-17 …
已知定义在R+上的函数f(x)同时满足下列三个条件:f(3)=-1;对任意x、y属于R+,都有f( 2020-06-03 …
英语翻译“我感觉爱无处不在;同时,伤痛也无时不在.”“Ifeelloveeverywhere;be 2020-06-07 …
自习课上,老师不在,同学们有的大声说话,有的话相互打闹,教室里乱成一片,如果你是班长,此刻你该怎么 2020-06-10 …
设f(x)定义在实数集R上,当x>0时,f(x)>1且对于任意x,y∈R,有f(x+y)=f(x) 2020-06-16 …
解释几个四字词语的意思如题:酣然大睡、无往不在、同中有异、止于此矣的意思 2020-06-21 …
游离的氨基和羧基(且都不在R基上)是什么意思请详说, 2020-07-14 …