早教吧作业答案频道 -->化学-->
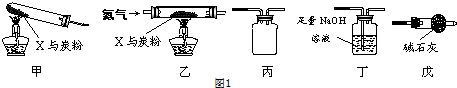
固体粉末X由Fe2O3、CuO组成.某研究性学习小组选用图1中装置(夹持仪器已略去,实验前均已检查装置气密性)探究X与过量炭粉发生反应时,除生成CO2外,是否还有其他气体产物.请回答:
题目详情
固体粉末X由Fe2O3、CuO组成.某研究性学习小组选用图1中装置(夹持仪器已略去,实验前均已检查装置气密性)探究X与过量炭粉发生反应时,除生成CO2外,是否还有其他气体产物.
请回答:
(1)若按甲→丙→丁的顺序连接装置,则___(填上图装置代号)装置中的仪器和试剂需称量.开始反应,气体经充分吸收后,分析数据发现,消耗碳、氧元素的质量大于生成CO2的质量,可能的原因除产生了CO2外的其他气体产物,还可能是___.
(2)为使实验测得的数据更能准确说明问题,一些同学按乙→丁→戊的顺序连接装置进行实验,并且加热前先通一会儿氮气,停止加热后再通一会儿氮气.停止加热后再通一会儿氮气的原因是___.
(3)以上两套装置均存在的同样的明显缺陷是___.
(4)该小组同学设计实验(如图2)将X进行转化(每一步均反应完全):
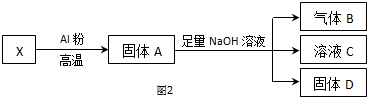
①生成气体B的化学方程式是___.
②将固体D投入过量稀硫酸并充分反应后,过滤,再向滤液加入双氧水,得黄色溶液.写出当加入双氧水时溶液中发生反应的离子方程式:___.
③若已知固体X的质量为7.2g,反应中Al粉的质量是2.7g,气体B在标准状况下的体积为672mL,则固体D的质量是___g.

请回答:
(1)若按甲→丙→丁的顺序连接装置,则___(填上图装置代号)装置中的仪器和试剂需称量.开始反应,气体经充分吸收后,分析数据发现,消耗碳、氧元素的质量大于生成CO2的质量,可能的原因除产生了CO2外的其他气体产物,还可能是___.
(2)为使实验测得的数据更能准确说明问题,一些同学按乙→丁→戊的顺序连接装置进行实验,并且加热前先通一会儿氮气,停止加热后再通一会儿氮气.停止加热后再通一会儿氮气的原因是___.
(3)以上两套装置均存在的同样的明显缺陷是___.
(4)该小组同学设计实验(如图2)将X进行转化(每一步均反应完全):

①生成气体B的化学方程式是___.
②将固体D投入过量稀硫酸并充分反应后,过滤,再向滤液加入双氧水,得黄色溶液.写出当加入双氧水时溶液中发生反应的离子方程式:___.
③若已知固体X的质量为7.2g,反应中Al粉的质量是2.7g,气体B在标准状况下的体积为672mL,则固体D的质量是___g.
▼优质解答
答案和解析
(1)分析数据发现,消耗碳、氧元素的质量大于生成CO2的质量,则需要称量反应前X和炭粉质量,反应后X和炭粉质量,前后质量差为减少的碳和氧元素的质量,反应生成二氧化碳的质量则可根据氢氧化钠增重得到;
因按甲→丙→丁的顺序连接装置,故需称量的装置为:甲、丁;根据质量守恒,消耗碳、氧元素的质量等于装置甲+装置丙+装置丁中二氧化碳的质量,装置甲和丙中有二氧化碳没有进入丁装置被氢氧化钠溶液吸收,故测得消耗碳、氧元素的质量大于生成CO2的质量,
故答案为:甲、丁;生成CO2气体残留在装置中;
(2)如果不排尽空气,那么空气中的氧气会与炭粉反应影响反应后生成气体的组成,所以利用稳定的氮气排空气,最后确保生成的二氧化碳完全吸收,反应后还要赶出所有的CO2,停止加热,装置内温度降低,压强变小,易发生倒吸现象,通入氮气可防止倒吸,
故答案为:将装置中残留的CO2气体吹出;防止溶液发生倒吸;
(3)气体制备或性质实验,要有尾气处理装置,此实验中,过量的炭粉和二氧化碳反应生成一氧化碳,一氧化碳有毒,可污染空气,必须有尾气处理装置,故答案为:无尾气处理装置;
(4)Fe2O3、CuO和铝在高温下发生铝热反应生成铁、铜和氧化铝,故固体A可能为铁、铜和氧化铝的混合物,加入足量氢氧化钠,有气体产生,铁、铜和氢氧化钠不反应,故A中还有剩余铝,故铝热反应中铝过量,X全部被还原,铝和氢氧化钠反应生成偏铝酸钠和氢气,氧化铝和氢氧化钠反应生成偏铝酸钠和水,固体D为铁和铜的混合物,在铁和铜中加入过量稀硫酸,铁和稀硫酸反应生成硫酸亚铁和氢气,铜不反应,生成的亚铁离子具有还原性,可被过氧化氢氧化,
①根据以上分析,铝热反应中铝过量,铝和氢氧化钠反应生成偏铝酸钠和氢气,反应的方程式为:
2Al+2NaOH+2H2O=2NaAlO+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO+3H2↑;
②固体D为铁和铜的混合物,在铁和铜中加入过量稀硫酸,铁和稀硫酸反应生成硫酸亚铁和氢气,铜不反应,生成的亚铁离子具有还原性,可被过氧化氢氧化,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③气体B为氢气,在标准状况下的体积为672mL,则物质的量为:
=0.03mol,根据反应方程式:
2Al+2NaOH+2H2O=2NaAlO+3H2↑可知,和氢氧化钠反应的铝为:0.02mol,参与铝热反应的铝为:
-0.02mol=0.08mol,形成氧化铝结合氧为:0.08mol×
=0.12mol,氧化铝中氧全来自X,故X中铁和铜的质量为:7.2g-0.12mol×16g/mol=5.28g,故答案为:5.28.
因按甲→丙→丁的顺序连接装置,故需称量的装置为:甲、丁;根据质量守恒,消耗碳、氧元素的质量等于装置甲+装置丙+装置丁中二氧化碳的质量,装置甲和丙中有二氧化碳没有进入丁装置被氢氧化钠溶液吸收,故测得消耗碳、氧元素的质量大于生成CO2的质量,
故答案为:甲、丁;生成CO2气体残留在装置中;
(2)如果不排尽空气,那么空气中的氧气会与炭粉反应影响反应后生成气体的组成,所以利用稳定的氮气排空气,最后确保生成的二氧化碳完全吸收,反应后还要赶出所有的CO2,停止加热,装置内温度降低,压强变小,易发生倒吸现象,通入氮气可防止倒吸,
故答案为:将装置中残留的CO2气体吹出;防止溶液发生倒吸;
(3)气体制备或性质实验,要有尾气处理装置,此实验中,过量的炭粉和二氧化碳反应生成一氧化碳,一氧化碳有毒,可污染空气,必须有尾气处理装置,故答案为:无尾气处理装置;
(4)Fe2O3、CuO和铝在高温下发生铝热反应生成铁、铜和氧化铝,故固体A可能为铁、铜和氧化铝的混合物,加入足量氢氧化钠,有气体产生,铁、铜和氢氧化钠不反应,故A中还有剩余铝,故铝热反应中铝过量,X全部被还原,铝和氢氧化钠反应生成偏铝酸钠和氢气,氧化铝和氢氧化钠反应生成偏铝酸钠和水,固体D为铁和铜的混合物,在铁和铜中加入过量稀硫酸,铁和稀硫酸反应生成硫酸亚铁和氢气,铜不反应,生成的亚铁离子具有还原性,可被过氧化氢氧化,
①根据以上分析,铝热反应中铝过量,铝和氢氧化钠反应生成偏铝酸钠和氢气,反应的方程式为:
2Al+2NaOH+2H2O=2NaAlO+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO+3H2↑;
②固体D为铁和铜的混合物,在铁和铜中加入过量稀硫酸,铁和稀硫酸反应生成硫酸亚铁和氢气,铜不反应,生成的亚铁离子具有还原性,可被过氧化氢氧化,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③气体B为氢气,在标准状况下的体积为672mL,则物质的量为:
| 0.672L |
| 22.4L/mol |
2Al+2NaOH+2H2O=2NaAlO+3H2↑可知,和氢氧化钠反应的铝为:0.02mol,参与铝热反应的铝为:
| 2.7g |
| 27g/mol |
| 3 |
| 2 |
看了 固体粉末X由Fe2O3、Cu...的网友还看了以下:
解方程ln|y|=x平方+c为什么y=+-e^(x^2+c)=+-e^c*e^(x^2)怎么解出的 2020-03-31 …
∫(0,+∞)xe^x/(1+e^x)^2dx,求出来了,但是感觉不对!原式=-∫xd[1/(1+ 2020-06-12 …
.1.∫f(x)dx=(e^x)cos2x+c,则f(x)=A.(e^x)(cos2x-2sin. 2020-07-10 …
方程转换x=ln(c*(e^y-1)/(e^y))如何转换成y=-In(1-ce^x), 2020-07-25 …
原例题解题过程:求微分方程y'+ytanx=secx的通解因为P(x)=tanx,Q(x)=sec 2020-07-31 …
类比“两角和与差的正弦、余弦公式”的形式,对于给定的两个函数S(x)=[e^x-e^(-x)]/2 2020-08-03 …
类比两角和与差的正弦,余弦公式,对于给定的两个函数S(X)=(E^X-E^-X)/2,C(X)=( 2020-08-03 …
y+c=x+bc,b都是常数他们都不等于0.现在问2个基础的问题,假如他们2边用1除,是变成1/(y 2020-11-20 …
概率论与数理统计习题已知随机变量X的概率密度为f(x)=c×e的(-x*x+x)次方,-∞<x<∞, 2020-12-13 …
数学--带入积分带入积分法求1.∫(x/x-1)dxx-1+ln(x-1)+c但怎么微分验算感觉我错 2020-12-19 …