早教吧作业答案频道 -->化学-->
小明设计了测定纯碱(Na2CO3)样品(假设只含NaCl杂质)中Na2CO3质量分数的实验方案,按如图进行实验.(1)滤液Y中含有的溶质有(填写化学式).(2)证明CaCl2已过量的方法是(填写
题目详情
小明设计了测定纯碱(Na2CO3)样品(假设只含NaCl杂质)中Na2CO3质量分数的实验方案,按如图进行实验.
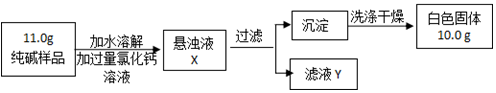
(1)滤液Y中含有的溶质有___(填写化学式).
(2)证明CaCl2已过量的方法是___(填写字母序号),然后观察现象判断.
A.静置悬浊液X,向上层清液中继续滴加少量氯化钙溶液
B.取少量滤液Y于试管中,滴加氯化钙溶液
(3)若沉淀没有洗涤操作会造成碳酸钠质量分数___(填“偏大”或“偏小”或“无影响”).
(4)通过以上提供的数据计算出样品中碳酸钠的质量分数为多少.(写出计算过程,结果保留至0.1%)

(1)滤液Y中含有的溶质有___(填写化学式).
(2)证明CaCl2已过量的方法是___(填写字母序号),然后观察现象判断.
A.静置悬浊液X,向上层清液中继续滴加少量氯化钙溶液
B.取少量滤液Y于试管中,滴加氯化钙溶液
(3)若沉淀没有洗涤操作会造成碳酸钠质量分数___(填“偏大”或“偏小”或“无影响”).
(4)通过以上提供的数据计算出样品中碳酸钠的质量分数为多少.(写出计算过程,结果保留至0.1%)
▼优质解答
答案和解析
(1)碳酸钠与氯化钙反应生成碳酸钙和氯化钠,又由于加入氯化钙溶液过量,所以滤液Y中含有的溶质NaCl和CaCl2;故填:NaCl和CaCl2;
(2)判断加入氯化钙溶液是否过量的合适方法是:静置悬浊液X,向上层清液中再滴加少量氯化钙溶液,如有沉淀生成,说明氯化钡溶液不足;由于要测定Na2CO3质量分数,所以只有证明CaCl2已过量,才可过滤,故选A;
(3)因为在沉淀表面的可溶性杂质氯化钠,所以沉淀洗涤的目的是:除去沉淀表面的可溶性杂质;若不洗涤,杂质氯化钠的质量当作沉淀物的质量,即样品中所含的碳酸根偏大,导致碳酸钠的质量分数偏大.故填:偏大;
(4)设样品中碳酸钠的质量是X
CaCl2+Na2CO3═CaCO3↓+2NaCl
106 100
X 10.0g
=
X=10.6g
所以样品中碳酸钠的质量分数是:
×100%=96.4%.
答:所以样品中碳酸钠的质量分数是96.4%.
(2)判断加入氯化钙溶液是否过量的合适方法是:静置悬浊液X,向上层清液中再滴加少量氯化钙溶液,如有沉淀生成,说明氯化钡溶液不足;由于要测定Na2CO3质量分数,所以只有证明CaCl2已过量,才可过滤,故选A;
(3)因为在沉淀表面的可溶性杂质氯化钠,所以沉淀洗涤的目的是:除去沉淀表面的可溶性杂质;若不洗涤,杂质氯化钠的质量当作沉淀物的质量,即样品中所含的碳酸根偏大,导致碳酸钠的质量分数偏大.故填:偏大;
(4)设样品中碳酸钠的质量是X
CaCl2+Na2CO3═CaCO3↓+2NaCl
106 100
X 10.0g
| 106 |
| X |
| 100 |
| 10.0g |
X=10.6g
所以样品中碳酸钠的质量分数是:
| 10.6g |
| 11.0g |
答:所以样品中碳酸钠的质量分数是96.4%.
看了 小明设计了测定纯碱(Na2C...的网友还看了以下:
已知0.2摩有机物和0.4摩氧气反应,生成水10.8克,产物通过氧化铜减轻3.2克,通过碱石灰增重 2020-05-22 …
下列关于hiv的rna在人体内发挥功能过程的叙述,错误的是:a.rna分子的复制,逆转录都要遵循碱 2020-06-05 …
高温,过酸,过碱会破坏蛋白质的肽键吗?怎么理解“高温,过酸,过碱会破坏蛋白质的空间结构”?高温,过 2020-07-13 …
填空题(不写过程)已知A,B两城市相距720千米,一列火车从A城去B城火车的速度V和行驶时间t之间 2020-08-02 …
填空题(不写过程)已知反比例函数y=x分之k+1的图像过点(-1,2),那么k的值等于()已知点A 2020-08-02 …
现有0.2mol有机物于0.5mol氧气在一密闭容器中燃烧,得产物为CO2、CO、H2O.产物通过浓 2020-10-31 …
碱石灰是由CaO和NaOH组成的固体混合物,常用作干燥剂.现对实验室已开封的久置在空气中的“碱石灰” 2020-11-12 …
0.2mol某一元醇,在密闭容器中燃烧后,其产物为CO2、CO、H2O.产物通过浓H2SO4后,浓H 2020-12-02 …
怎样写好过新年的作文?寒假作业老师布置我们要写两篇日记,我已经写我了一篇,第二篇我想写过新年,可我写 2020-12-12 …
把之前写过的英语作文上传到turnitin上算抄袭吗?之前写过的已经上传过turnitin了 2020-12-17 …