常温下,向10ml0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是()A.a~b点导电能力增强,说明HR为弱酸B.b点溶液pH=5,此时
常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )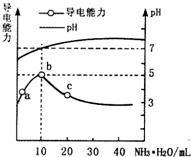
A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=5,此时酸碱恰好中和
C. c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
D. b~c任意点溶液均有c(H+)•c(OH-)=Kw=1.0×10-14
B.体积图象可知b点溶液pH=7,此时HR与一水合氨的物质的量相等,二者恰好反应生成NH4R,铵根离子与R-的水解程度相等,故B错误;
C.根据图象可知,c点时溶液的pH>7,混合液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-),故C正确;
D.常温下水的离子积为:KW=c(H+)×c(OH-)=1.0×10-14,由于b-c点溶液的反应温度相同,则水的离子积不变,故D正确;
故选B.
下列叙述正确的是A.蔗糖溶液不导电,因此蔗糖溶液是非电解质B.醋酸溶液的导电能力可能比稀硫酸强C. 2020-04-12 …
PtCl4•2NH3水溶液不导电加入AgNO3无现象加强碱无NH3放出下列说法正确的是()A.配合 2020-05-13 …
某物质的化学式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液不产生沉淀,加入强碱也没有 2020-05-13 …
某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,用强碱处理并 2020-05-13 …
某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处 2020-05-13 …
某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,以强碱处理也 2020-05-13 …
PtCl4·2NH3水溶液不导电加入AgNO3无现象加强碱无NH3放出下列说法正确的是()A.配合 2020-05-13 …
某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,以强碱处理并 2020-05-13 …
某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处 2020-07-03 …
哪些溶液导电哪些溶液不导电 2020-07-26 …