早教吧作业答案频道 -->化学-->
二氧化碳的回收利用是环保领域研究的热点课题.(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)△H在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图1所示不同温度(
题目详情
二氧化碳的回收利用是环保领域研究的热点课题.
(1)CO2经催化加氢可合成低碳烯烃:
2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)△H在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系.
①该反应的△H___0(填“>”、“=”或“<”).
②为提高CO2的平衡转化率,除改变温度外,还可采取的措施是___.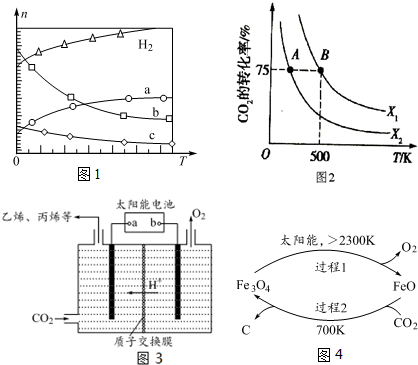
(2)向2L恒容密闭容器中充入2mol CO2(g)和n mol H2(g),在一定条件下发生(1)中反应.CO2的转化率与温度、投料比 X=
的关系如图2所示:
①X1___X2(填“<”、“>”或“=”,下同),平衡常数K(A)___K(B).
②若B点的投料比为3,则平衡常数K(B)为___(结果保留小数后一位).若反应从开始到B点需要10min,则v(H2)=___.
(3)在强酸性的电解质水溶液中,惰性材料做电极,利用太阳能将CO2转化成低碳烯烃,工作原理如图3所示.
①该工艺中能量转化方式主要有___.
②b为电源的___(填“正”或“负”)极,电解时,生成丙烯的电极反应式是___
(4)以CO2为原料制取碳(C)的太阳能工艺如图4所示.
①过程1中发生反应的化学方程式为___.
②过程2中每生成1mol Fe3O4转移电子的物质的量为___.
(1)CO2经催化加氢可合成低碳烯烃:
2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)△H在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系.
①该反应的△H___0(填“>”、“=”或“<”).
②为提高CO2的平衡转化率,除改变温度外,还可采取的措施是___.

(2)向2L恒容密闭容器中充入2mol CO2(g)和n mol H2(g),在一定条件下发生(1)中反应.CO2的转化率与温度、投料比 X=
| n(H2) |
| n(CO2) |
①X1___X2(填“<”、“>”或“=”,下同),平衡常数K(A)___K(B).
②若B点的投料比为3,则平衡常数K(B)为___(结果保留小数后一位).若反应从开始到B点需要10min,则v(H2)=___.
(3)在强酸性的电解质水溶液中,惰性材料做电极,利用太阳能将CO2转化成低碳烯烃,工作原理如图3所示.
①该工艺中能量转化方式主要有___.
②b为电源的___(填“正”或“负”)极,电解时,生成丙烯的电极反应式是___
(4)以CO2为原料制取碳(C)的太阳能工艺如图4所示.
①过程1中发生反应的化学方程式为___.
②过程2中每生成1mol Fe3O4转移电子的物质的量为___.
▼优质解答
答案和解析
(1)①由图可知,升高温度,氢气物质的量增大,说明平衡逆向移动,则正反应是放热反应,故△H<0,
故答案为:<;
②反应前后气体体积减小,为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强,
故答案为:增大压强;
(2)①相同条件下,投料比[X=
]越大,二氧化碳的转化率越大,根据图知,相同温度下X1的转化率大于X2,所以X1>X2;该反应的正反应是放热反应,温度越高其平衡常数越小,温度A<B,所以平衡常数A>B,
故答案为:>;>;
②若B点的投料比为3,且从反应开始到B点需要10min,n(CO2)=2mol,则n(H2)=6mol,B点二氧化碳的转化率为75%,则参加反应的n(CO2)=2mol×75%=1.5mol,
2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.375 1.5
平衡量(mol/L) 0.25 0.75 0.375 1.5
K=
=170.7,
根据二氧化碳和氢气之间的关系式知,参加反应的n(H2)=3n(CO2)=4.5mol,则v(H2)=
=
=0.225mol/(L.min),
故答案为:170.7; 0.225mol/(L•min);
(3)①在强酸性的电解质水溶液中,惰性材料做电极,利用太阳能将CO2转化成低碳烯烃,工作原理图可知,能量变化为:太阳能转化为电能,电能转化为化学能,
故答案为:太阳能转化为电能,电能转化为化学能;
②根据图知,生成氧气的电极是阳极,则连接阳极的电源电极为正极,所以b为正极,阴极上二氧化碳得电子和氢离子反应生成丙烯和水,电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O,
故答案为:正极;3CO2+18H++18e-=CH3CH=CH2+6H2O;
(4)①根据图知,Fe3O4在大于2300K时分解为FeO与O2,反应方程式为2Fe3O4
6FeO+O2↑,
故答案为:2Fe3O4
6FeO+O2↑;
②发生反应:6FeO(S)+CO2
2Fe3O4(S)+C,生成1mol Fe3O4时可以得到C的物质的量为0.5mol,转移电子为0.5mol×4=2mol,
故答案为:2mol.
故答案为:<;
②反应前后气体体积减小,为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强,
故答案为:增大压强;
(2)①相同条件下,投料比[X=
| n(H2) |
| n(CO2) |
故答案为:>;>;
②若B点的投料比为3,且从反应开始到B点需要10min,n(CO2)=2mol,则n(H2)=6mol,B点二氧化碳的转化率为75%,则参加反应的n(CO2)=2mol×75%=1.5mol,
2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.375 1.5
平衡量(mol/L) 0.25 0.75 0.375 1.5
K=
| 1.54×0.35 |
| 0.252×0.756 |
根据二氧化碳和氢气之间的关系式知,参加反应的n(H2)=3n(CO2)=4.5mol,则v(H2)=
| ||
| △t |
| ||
| 10min |
故答案为:170.7; 0.225mol/(L•min);
(3)①在强酸性的电解质水溶液中,惰性材料做电极,利用太阳能将CO2转化成低碳烯烃,工作原理图可知,能量变化为:太阳能转化为电能,电能转化为化学能,
故答案为:太阳能转化为电能,电能转化为化学能;
②根据图知,生成氧气的电极是阳极,则连接阳极的电源电极为正极,所以b为正极,阴极上二氧化碳得电子和氢离子反应生成丙烯和水,电极反应式为3CO2+18H++18e-=CH3CH=CH2+6H2O,
故答案为:正极;3CO2+18H++18e-=CH3CH=CH2+6H2O;
(4)①根据图知,Fe3O4在大于2300K时分解为FeO与O2,反应方程式为2Fe3O4
| ||
故答案为:2Fe3O4
| ||
②发生反应:6FeO(S)+CO2
| ||
故答案为:2mol.
看了 二氧化碳的回收利用是环保领域...的网友还看了以下:
下列有关金属冶炼的说法中错误的是()A.炼铁中加入焦炭作造渣剂B.炼钢中吹入氧气作氧化剂C.电解铝 2020-05-14 …
为什么同一元素含氧酸随元素价态降低氧化性增强,酸性减弱?不是说元素的化学价越高,物质的氧化性越强嘛 2020-05-16 …
有关铝氧化铝可不可以直接转化为氢氧化铝,铝离子可不可以直接转化为偏铝酸根?可以的话,请写出方程式为 2020-06-20 …
氧化态的高低与共价性离子性强弱的关系?高氧化态化合物为共价化合物,低氧化态的化合物离子性较强.这个 2020-07-01 …
高中化学急用~~碳的稳定的氧化物除CO、CO2外,还有C3O2、C4O3、C5O2、C12O9等低 2020-07-09 …
已知甲元素是第三周期p区元素,其最低氧化值为-1,乙元素是第四周期d区元素,其最高氧化值为+4,试填 2020-12-31 …
(8分)已知甲元素是第三周期p区元素,其最低氧化值为-1,乙元素是第四周期d区元素,其最高氧化值为+ 2020-12-31 …
下列说法正确的是A.红外光谱仪、质谱仪、核磁共振仪、紫外光谱仪和元素分析仪都是用于测定有机物结构的现 2021-02-09 …
下列说法正确的是()A.红外光谱仪、质谱仪、核磁共振仪、紫外光谱仪和元素分析仪都是用于测定有机物结构 2021-02-09 …
下列说法正确的是()A.红外光谱仪、质谱仪、核磁共振仪、紫外光谱仪和元素分析仪都是用于测定有机物结构 2021-02-09 …