早教吧作业答案频道 -->化学-->
氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂,某研究性学习小组模拟生产企业制取氢化钙.查阅资料Ⅰ白色的无水硫酸铜粉末吸水后会变蓝;Ⅱ碱石灰是氧
题目详情
氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂,某研究性学习小组模拟生产企业制取氢化钙.
【查阅资料】
Ⅰ白色的无水硫酸铜粉末吸水后会变蓝;
Ⅱ碱石灰是氧化钙和氢氧化钠的混合物;
Ⅲ钙、氢化钙遇水立即发生剧烈反应:Ca+2H2O=Ca(OH)2+H2↑;CaH2+2H2O=Ca(OH)2+2H2↑;
Ⅳ钙能燃烧生成氧化钙;氢化钙能燃烧生成氧化钙和水.
【实验原理】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2.
(1)同学们设计了以下实验装置: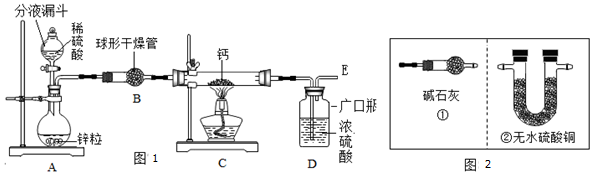
请回答:
①装置A中发生反应的化学方程式为___;为了实验安全,点燃C装置酒精灯前应先___;
②上图1装置B中装有无水氯化钙,其作用是干燥H2,若要证明进入C装置中的氢气已经干燥,在B、C之间应连接图2中的___(选填:①或②)装置;
③图1装置D中浓硫酸的作用是___;
【进行实验)过程略
【验证产物】略
【实验拓展】(2)定性实验用化学方法鉴别Ca与CaH2,完成下表中内容.
(3)定量实验:测定Ca和CaH2混合物中CaH2的质量分数.
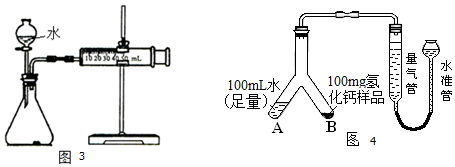
①取m1g样品与水完全反应,利用如图3装置测定生成的气体体积时,在___时进行收集(选填字母);
a.刚开始有气泡时 b.气泡连续均匀冒出时 C.气体经过验纯
②按图3实验装置进行测定时,甲同学发现,即使气密性良好,操作正确,测得的气体体积还是偏大,可能原因是___;(写出任一点即可)
③乙同学将实验装置改进为如图4(固定装置省略)所示,调整水准管高度,使量气装置两边的液面保持在同一水平面上,读取量气管中液面所示刻度为10.0mL.将Y形管慢慢倾斜,直至A中的水全部倒入B中,与样品混合反应,待反应结束后,冷却至室温,再次调节量气管与水准管液面相平,读取量气管中液面所示刻度为98.9mL.已知该实验条件下,氢气的密度为0.09mg/mL.样品中氢化钙的质量分数为___;(结果精确到0.1%)
【反思与交流】
(4)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便.既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是___.
【查阅资料】
Ⅰ白色的无水硫酸铜粉末吸水后会变蓝;
Ⅱ碱石灰是氧化钙和氢氧化钠的混合物;
Ⅲ钙、氢化钙遇水立即发生剧烈反应:Ca+2H2O=Ca(OH)2+H2↑;CaH2+2H2O=Ca(OH)2+2H2↑;
Ⅳ钙能燃烧生成氧化钙;氢化钙能燃烧生成氧化钙和水.
【实验原理】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2.
(1)同学们设计了以下实验装置:

请回答:
①装置A中发生反应的化学方程式为___;为了实验安全,点燃C装置酒精灯前应先___;
②上图1装置B中装有无水氯化钙,其作用是干燥H2,若要证明进入C装置中的氢气已经干燥,在B、C之间应连接图2中的___(选填:①或②)装置;
③图1装置D中浓硫酸的作用是___;
【进行实验)过程略
【验证产物】略
【实验拓展】(2)定性实验用化学方法鉴别Ca与CaH2,完成下表中内容.
| 实验步骤 | 预期现象和结论 |
| 取少量固体样品,在干燥条件下与氧气反应,将 其产物通入装有无水硫酸铜的干燥管; | ___ |

①取m1g样品与水完全反应,利用如图3装置测定生成的气体体积时,在___时进行收集(选填字母);
a.刚开始有气泡时 b.气泡连续均匀冒出时 C.气体经过验纯
②按图3实验装置进行测定时,甲同学发现,即使气密性良好,操作正确,测得的气体体积还是偏大,可能原因是___;(写出任一点即可)
③乙同学将实验装置改进为如图4(固定装置省略)所示,调整水准管高度,使量气装置两边的液面保持在同一水平面上,读取量气管中液面所示刻度为10.0mL.将Y形管慢慢倾斜,直至A中的水全部倒入B中,与样品混合反应,待反应结束后,冷却至室温,再次调节量气管与水准管液面相平,读取量气管中液面所示刻度为98.9mL.已知该实验条件下,氢气的密度为0.09mg/mL.样品中氢化钙的质量分数为___;(结果精确到0.1%)
【反思与交流】
(4)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便.既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是___.
▼优质解答
答案和解析
(1)
①装置A中,是锌粒与稀硫酸反应生成硫酸锌和氢气.对应的化学方程式为 Zn+H2SO4═ZnSO4+H2↑;由于氢气具有可燃性,为防止使用过程因为装置内有空气(氧气)而导致氢气爆炸,所以在点燃C装置酒精灯前应先在E导管口收集氢气进行验纯或先通一会儿氢气;
②上图1装置B中装有无水氯化钙,其作用是干燥H2,检验水蒸气应该使用无水硫酸铜,所以若要证明进入C装置中的氢气已经干燥,在B、C之间应连接图2中的 ②装置;
③图1装置D中浓硫酸的作用是 防止空气中的水蒸汽进入C中;
【实验拓展】(2)由于“钙能燃烧生成氧化钙;氢化钙能燃烧生成氧化钙和水“,所以 鉴定钙或者碳化钙,可以借助点燃固体检验对应物质是否含水,所以有如下的实验:
(3)定量实验:测定Ca和CaH2混合物中CaH2的质量分数.
①取m1g样品与水完全反应,利用如图3装置测定生成的气体体积时,由于生成的气体占有体积,所以从开始就应该收集,而不是强调达到一定纯度才可以收集,所以选:a.
②按图3实验装置进行测定时,由于滴入的液体是有体积的,滴入后导致右侧的体积变大,同时无论是钙还是氢化钙和水反应都有热量放出,导致气体体积膨胀,都会影响结果,所以,即使气密性良好,操作正确,测得的气体体积还是偏大.
③反应前读取量气管中液面所示刻度为10.0mL,反应后读取量气管中液面所示刻度为98.9mL,则生成的氢气的体积为99.9mL-10.0mL=88.9mL.已知该实验条件下,氢气的密度为0.09mg/mL.则生成的氢气的质量为88.9mL×0.09mg/mL≈8mg.
设氢化钙的质量为x,则钙的质量为100mg-x.
Ca+2H2O=Ca(OH)2+H2↑;
40 2
100mg-x
CaH2+2H2O=Ca(OH)2+2H2↑;
42 4
x
x
+
x=8mg
x≈66.3mg
样品中氢化钙的质量分数为
×100%=66.3%;
【反思与交流】
(4)设钙和CaH2的质量均为ag.钙对应的氢气的质量为x,氢化钙对应的氢气为y.
Ca+2H2O=Ca(OH)2+H2↑;
40 2
ag x
=
x=
ag
CaH2+2H2O=Ca(OH)2+2H2↑;
42 4
ag y
=
y=
ag
可见x<y
即:等质量的钙和CaH2与水完全反应,CaH2产生的氢气多.
故答案为:
(1)①Zn+H2SO4═ZnSO4+H2↑;在E导管口收集氢气进行验纯或先通一会儿氢气;
②②;
③防止空气中的水蒸汽进入C中;
(2)若观察到无水硫酸铜变蓝色,证明是氢化钙,反之是钙(其他合理答案同样给分);
(3)①a;②因液体加入引起气体排出(或反应放热气体温度升高,体积膨胀引起气体排出),导致气体体积测定变大;③66.3%;
(4)等质量的钙和CaH2与水完全反应,CaH2产生的氢气多.
(1)
①装置A中,是锌粒与稀硫酸反应生成硫酸锌和氢气.对应的化学方程式为 Zn+H2SO4═ZnSO4+H2↑;由于氢气具有可燃性,为防止使用过程因为装置内有空气(氧气)而导致氢气爆炸,所以在点燃C装置酒精灯前应先在E导管口收集氢气进行验纯或先通一会儿氢气;
②上图1装置B中装有无水氯化钙,其作用是干燥H2,检验水蒸气应该使用无水硫酸铜,所以若要证明进入C装置中的氢气已经干燥,在B、C之间应连接图2中的 ②装置;
③图1装置D中浓硫酸的作用是 防止空气中的水蒸汽进入C中;
【实验拓展】(2)由于“钙能燃烧生成氧化钙;氢化钙能燃烧生成氧化钙和水“,所以 鉴定钙或者碳化钙,可以借助点燃固体检验对应物质是否含水,所以有如下的实验:
| 实验步骤 | 预期现象和结论 |
| 取少量固体样品,在干燥条件下与氧气反应,将 其产物通入装有无水硫酸铜的干燥管; | 若观察到无水硫酸铜变蓝色,证明是氢化钙,反之是钙 |
①取m1g样品与水完全反应,利用如图3装置测定生成的气体体积时,由于生成的气体占有体积,所以从开始就应该收集,而不是强调达到一定纯度才可以收集,所以选:a.
②按图3实验装置进行测定时,由于滴入的液体是有体积的,滴入后导致右侧的体积变大,同时无论是钙还是氢化钙和水反应都有热量放出,导致气体体积膨胀,都会影响结果,所以,即使气密性良好,操作正确,测得的气体体积还是偏大.
③反应前读取量气管中液面所示刻度为10.0mL,反应后读取量气管中液面所示刻度为98.9mL,则生成的氢气的体积为99.9mL-10.0mL=88.9mL.已知该实验条件下,氢气的密度为0.09mg/mL.则生成的氢气的质量为88.9mL×0.09mg/mL≈8mg.
设氢化钙的质量为x,则钙的质量为100mg-x.
Ca+2H2O=Ca(OH)2+H2↑;
40 2
100mg-x
| 100mg-x |
| 20 |
CaH2+2H2O=Ca(OH)2+2H2↑;
42 4
x
| 4 |
| 42 |
| 100mg-x |
| 20 |
| 4 |
| 42 |
x≈66.3mg
样品中氢化钙的质量分数为
| 66.3mg |
| 100mg |
【反思与交流】
(4)设钙和CaH2的质量均为ag.钙对应的氢气的质量为x,氢化钙对应的氢气为y.
Ca+2H2O=Ca(OH)2+H2↑;
40 2
ag x
| 40 |
| 2 |
| ag |
| x |
x=
| 1 |
| 20 |
CaH2+2H2O=Ca(OH)2+2H2↑;
42 4
ag y
| 42 |
| 4 |
| ag |
| y |
y=
| 2 |
| 21 |
可见x<y
即:等质量的钙和CaH2与水完全反应,CaH2产生的氢气多.
故答案为:
(1)①Zn+H2SO4═ZnSO4+H2↑;在E导管口收集氢气进行验纯或先通一会儿氢气;
②②;
③防止空气中的水蒸汽进入C中;
(2)若观察到无水硫酸铜变蓝色,证明是氢化钙,反之是钙(其他合理答案同样给分);
(3)①a;②因液体加入引起气体排出(或反应放热气体温度升高,体积膨胀引起气体排出),导致气体体积测定变大;③66.3%;
(4)等质量的钙和CaH2与水完全反应,CaH2产生的氢气多.
看了 氢化钙(CaH2)是一种常用...的网友还看了以下:
分别写出制取下列各物质的化学方程式:(1)以石灰石为原料制取熟石灰.(2)以生石灰,纯碱为原料制取 2020-06-03 …
工业上用含的铜矿石炼铜的一种方法是:先将矿石在空气中高温灼烧生成和气体A,再将得到的固体与铜矿石( 2020-06-28 …
根据所提供的材料,回答下列问题.材料:日本进口的主要工业原料所占百分比及主要工业产品占世界市场百分比 2020-11-04 …
读图,阅读材料完成下列要求.材料:20世纪末日本进口的主要物资所占百分比和出口产品占世界市场百分比表 2020-11-04 …
(2009•安庆)如图、表分别为日本主要工业中心分布示意图和主要工业原料进口比例及主要工业产品出口比 2020-11-04 …
(7分)人类在新石器时代晚期开始利用天然金属,此后逐渐以矿石为原料冶铸铜器,中国古代还发明了火法炼铜 2020-11-06 …
(7分)人类在新石器时代晚期开始利用天然金属,此后逐渐以矿石为原料冶铸铜器,中国古代还发明了火法炼铜 2020-11-06 …
某铜矿石的主要成分是氧化铜,氧化亚铜,还有少量的氧化铁和二氧化硅,利用该铜矿石制铜并得到硫酸亚铁溶液 2020-12-05 …
人类在新石器时代晚期开始利用天然金属,此后逐渐以矿石为原料冶铸铜器,中国古代还发明了火法炼铜和水法炼 2021-01-01 …
人类在新石器时代晚期开始利用天然金属,此后逐渐以矿石为原料冶铸铜器,中国古代还发明了火法炼铜和水法炼 2021-01-01 …