早教吧作业答案频道 -->化学-->
开发新型储氢材料是氢能利用的重要研究方向.(1)Ti(BH4)3是一种储氢材料,可由TiCl4和BH4反应制得.①Ti的基态原子外围电子排布式为.②LiBH4由Li+和BH4-构成,BH4-的空间构型是,BH4
题目详情
开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和BH4反应制得.
①Ti的基态原子外围电子排布式为___.
②LiBH4由Li+和BH4-构成,BH4-的空间构型是___,BH4-中B原子的杂化类型为___,LiBH4中存在的作用力有___.
③LiBH4元素的电负性由大到小排列顺序为___.
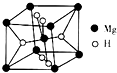
(2)MgH2也是一种储氢材料,其晶胞结构如图所示.
已知该晶胞的体积为V cm3,则该晶体的密度为___[用V、NA表示(其中NA为阿伏加德罗常数的值)].MgH2要密封保存,通水会缓慢反应.反应的化学方程式为___.
(3)金属晶体中存在一种堆积方式叫立方最密堆积,其配位数为___,空间利用率为___.一种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氧后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为___.

(1)Ti(BH4)3是一种储氢材料,可由TiCl4和BH4反应制得.
①Ti的基态原子外围电子排布式为___.
②LiBH4由Li+和BH4-构成,BH4-的空间构型是___,BH4-中B原子的杂化类型为___,LiBH4中存在的作用力有___.
③LiBH4元素的电负性由大到小排列顺序为___.
(2)MgH2也是一种储氢材料,其晶胞结构如图所示.
已知该晶胞的体积为V cm3,则该晶体的密度为___[用V、NA表示(其中NA为阿伏加德罗常数的值)].MgH2要密封保存,通水会缓慢反应.反应的化学方程式为___.
(3)金属晶体中存在一种堆积方式叫立方最密堆积,其配位数为___,空间利用率为___.一种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氧后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为___.
▼优质解答
答案和解析
(1)①Ti的原子序数为22,原子核外有22个电子,其3d、4s能级电子为其价电子,根据原子核外电子排布规律知,其价电子排布式为3d24s2,
故答案为:3d24s2;
②BH4-中B原子价层电子数=4+
=4,且不含孤电子对,所以是正四面体构型,B原子采用sp3杂化,Li+和BH-4之间存在离子键,硼原子和氢原子之间存在共价键、配位键,所以该化合物中不含金属键,
故答案为:正四面体;sp3;离子键、共价键和配位键;
③非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li,
故答案为:H>B>Li;
(2)该晶胞中Mg原子=8×
+1=2,H原子个数=2+4×
=4,其密度=
=
=
g/cm3=
g/cm3;MgH2和水反应生成氢氧化镁和氢气,反应方程式为MgH2+H2O=Mg(OH)2↓+H2↑,
故答案为:
g/cm3;MgH2+H2O=Mg(OH)2↓+H2↑;
(3)金属晶体中存在一种堆积方式叫立方最密堆积,其配位数为12,空间利用率为74%,该晶胞中Au原子个数=8×
=1、Cu原子个数=6×
=3,氢原子可进入到Cu原子与Au原子构成的四面体空隙中,H原子应位于晶胞内部,氢原子相当于该晶胞中的F离子,所以该晶胞中应含有8个H,所以其化学式为Cu3AuH8,
故答案为:12;74%;Cu3AuH8.
故答案为:3d24s2;
②BH4-中B原子价层电子数=4+
| 3+1-4×1 |
| 2 |
故答案为:正四面体;sp3;离子键、共价键和配位键;
③非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li,
故答案为:H>B>Li;
(2)该晶胞中Mg原子=8×
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| ||
| V |
| ||
| V |
| 52 |
| VNA |
故答案为:
| 52 |
| VNA |
(3)金属晶体中存在一种堆积方式叫立方最密堆积,其配位数为12,空间利用率为74%,该晶胞中Au原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:12;74%;Cu3AuH8.
看了 开发新型储氢材料是氢能利用的...的网友还看了以下:
高数“ 设X轴正向到方向L的转角为φ,求函数f(x,y)=x^2-xy+y^2 在点(1,1)沿方 2020-05-16 …
英语翻译论文分两个部分进行,第一部分是在确定了香蕉中酪氨酸酶的最佳吸收峰518.5nm的条件下,在 2020-06-05 …
椭圆C的中心为坐标原点O,焦点在y轴上,焦点到相应准线的距离以及离心率e=根号2/2,直线l与y轴 2020-06-21 …
已知过点A(-4,0)的动直线L与抛物线C:X平方=2PY(p>0)相交于B.C两点.当L得斜率是 2020-07-21 …
已知过点A(-4,0)的动直线L与抛物线C:X平方=2PY(p>0)相交于B.C两点.当L得斜率是 2020-07-22 …
计算:(1)l-3l*l6.2l(2)l-5l+l2.49l(3)十六分之一-l-八分之三l(4) 2020-08-01 …
气温为23℃时,某河段溶解氧浓度为4.5mg/L,其指数为()(根据GB,Ⅱ类水体溶解氧标准为≥6m 2020-11-28 …
四个地理题,急求答案!1我国领海是指从海岸线基线向海上延伸到:海里2我国陆上疆域总长达:千米3北回归 2020-12-05 …
近年来,公务员招考更重视基层经历,基层干部被赋予更多的发展机会和更广阔的发展空间。回答l-2题。1. 2020-12-17 …
一个数学题,希望各位有能力的帮帮小女子吧.特别是第2问,已知过点A(-4,0)的动直线L与抛物线C: 2021-02-11 …