早教吧作业答案频道 -->化学-->
碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图1所示.放电时总反应为:Zn+2H2O+2MnO2═Zn(OH)2+2MnOOH从废旧碱性锌锰电池中回收Zn和MnO2的工艺如图2:回答下列问题:(1)MnOOH中,M
题目详情
碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图1所示.放电时总反应为:
Zn+2H2O+2MnO2═Zn(OH)2+2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如图2:
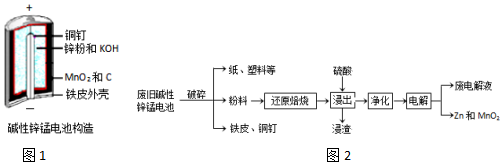
回答下列问题:
(1)MnOOH中,Mn元素的化合价为___.
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有___.
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入___(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀.已知浸出液中Mn2+、Zn2+的浓度约为0.1mol•L-1,根据下列数据计算,调节pH的合理范围是___至___.
(离子浓度小于1×10-5mol•L-1即为沉淀完全)
(4)“电解”时,阳极的电极反应式为___.本工艺中应循环利用的物质是___(填化学式).
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2.“粉料”中的MnOOH与盐酸反应的化学方程式为___.
(6)某碱性锌锰电池维持电流强度0.5A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效.如果制造一节电池所需的锌粉为6g,则电池失效时仍有___%的金属锌未参加反应.
Zn+2H2O+2MnO2═Zn(OH)2+2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如图2:

回答下列问题:
(1)MnOOH中,Mn元素的化合价为___.
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有___.
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入___(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀.已知浸出液中Mn2+、Zn2+的浓度约为0.1mol•L-1,根据下列数据计算,调节pH的合理范围是___至___.
| 化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
| KSP近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为___.本工艺中应循环利用的物质是___(填化学式).
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2.“粉料”中的MnOOH与盐酸反应的化学方程式为___.
(6)某碱性锌锰电池维持电流强度0.5A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效.如果制造一节电池所需的锌粉为6g,则电池失效时仍有___%的金属锌未参加反应.
▼优质解答
答案和解析
(1)根据化合价代数和为0,MnOOH中,Mn元素的化合价为+3价,故答案为:+3;
(2)废旧碱性锌锰电池粉料中含有碳具有还原性,“还原焙烧”过程中,碳将高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),故答案为:C;
(3)“净化”是为了除去浸出液中的Fe2+,利用H2O2溶液具有氧化性将Fe2+氧化为Fe3+,再由Mn(OH)2、Zn(OH)2的KSP近似值可求得Mn2+,Zn2+开始沉淀时的氢氧根浓度分别为
=10-6,
=10-8,即Mn2+,Zn2+开始沉淀时的pH分别为8和6,而Fe(OH)3沉淀完全时的氢氧根浓度为
=10-11,即
Fe(OH)3沉淀完全时的pH为3,所以调节pH的合理范围是 3-6,使Fe3+完全沉淀,Mn2+,Zn2+不沉淀,故答案为:H2O2;3;6;
(4)电解阳极Mn2+失电子发生氧化反应生成MnO2,阳极的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,阴极Zn2+得电子发生还原反应生成Zn,废电解液为硫酸,则本工艺中应循环利用的物质是H2SO4,故答案为:Mn2+-2e-+2H2O=MnO2+4H+;H2SO4;
(5)“粉料”中的MnOOH具有氧化性,与盐酸发生氧化还原反应,则反应的化学方程式为2MnOOH+6HCl
2MnCl2+4H2O+Cl2↑,故答案为:2MnOOH+6HCl
2MnCl2+4H2O+Cl2↑;
(6)80分钟转移电子的物质的量为5×10-6 mol×80×60=0.024mol,则消耗的Zn的质量为
×65g/mol=0.78g,所以如果制造一节电池所需的锌粉为6g,则电池失效时仍有
×100%=87%的金属锌未参加反应,故答案为:87.
(2)废旧碱性锌锰电池粉料中含有碳具有还原性,“还原焙烧”过程中,碳将高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),故答案为:C;
(3)“净化”是为了除去浸出液中的Fe2+,利用H2O2溶液具有氧化性将Fe2+氧化为Fe3+,再由Mn(OH)2、Zn(OH)2的KSP近似值可求得Mn2+,Zn2+开始沉淀时的氢氧根浓度分别为
|
|
| 3 |
| ||
Fe(OH)3沉淀完全时的pH为3,所以调节pH的合理范围是 3-6,使Fe3+完全沉淀,Mn2+,Zn2+不沉淀,故答案为:H2O2;3;6;
(4)电解阳极Mn2+失电子发生氧化反应生成MnO2,阳极的电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,阴极Zn2+得电子发生还原反应生成Zn,废电解液为硫酸,则本工艺中应循环利用的物质是H2SO4,故答案为:Mn2+-2e-+2H2O=MnO2+4H+;H2SO4;
(5)“粉料”中的MnOOH具有氧化性,与盐酸发生氧化还原反应,则反应的化学方程式为2MnOOH+6HCl
| ||
| ||
(6)80分钟转移电子的物质的量为5×10-6 mol×80×60=0.024mol,则消耗的Zn的质量为
| 0.024mol |
| 2 |
| 6-0.78 |
| 6 |
看了 碱性锌锰电池是日常生活中消耗...的网友还看了以下:
一点小数学问题1.⊙O是△ABC的外接圆,⊙O的半径R=2,sinB=3/4,则弦AC的长为多少?2 2020-03-30 …
关于Cl[2]O的一道题Cl[2]O常用NaClO[3]和Na[2]SO[3]溶液混合并加H[2] 2020-04-11 …
如图一艘快艇从o港出发,向东北方向行驶到A处,然后西行驶到B处,再向东南方向行驶,共经过2时回到O 2020-04-25 …
设已知关于x的方程ax^2+(a+2)x+9a=0有两个不相等的实数根X1,X2,且X1<1<X2 2020-05-13 …
请问,这3种化学物质怎么读,dianionoftetrafluoro-1,2-benzenedio 2020-05-15 …
镁条在空气中点燃,反应结束后生成物全部收回称量,为什么所称得的质量比反应前质量增加了?但是根据质量 2020-05-20 …
∵EM是⊙O的切线,怎么推出EB•EC=EM2①?,看题后回答.(2005•温州)如图,已知四边形 2020-05-21 …
无穷小运算证明:1o(x^2)+o(x^3)=o(x^2)2x·o(x^2)=o(x^3)说是用定 2020-06-03 …
在直角三角ABC中,角A等于90度,AC=9,点O在AC上,且AO=2,点P是AB上一动点,连接O 2020-06-06 …
设A为实方针,证明(1)如果A=At(转置矩阵),且A^2=O,则A=O;(2)如果A*AT=O, 2020-06-22 …