早教吧作业答案频道 -->化学-->
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1;W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构
题目详情
周期表中前四周期元素R、W、X、Y、Z 的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1;W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子.请回答下列问题:
(1)写出Z的基态原子外围电子排布___.
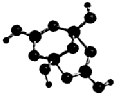
(2)R的某种钠盐晶体,其阴离子Am-(含R、W、氢三种元素)的球棍模型如图所示:在Am-中,R原子轨道杂化类型有___;m=___.(填数字)
(3)经X射线探明,X与W形成化合物的晶体结构与NaCl的晶体结构相似,X2+的配位原子所构成的立体几何构型为___.
(4)往Z的硫酸盐溶液中加入过量氨水,可生成[Z(NH3)4]SO4,下列说法正确的是___.
A.[Z(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(NH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.[Z(NH3)4]SO4组成元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为四面体
(5)固体YCl5的结构实际上是YCl4+和YCl6-构成的离子晶体,其晶体结构与CsCl相似.若晶胞边长为apm,则晶胞的密度为___g•cm-3.(已知阿伏伽德罗常数为NA,用含a和NA的代数式表示)

(1)写出Z的基态原子外围电子排布___.
(2)R的某种钠盐晶体,其阴离子Am-(含R、W、氢三种元素)的球棍模型如图所示:在Am-中,R原子轨道杂化类型有___;m=___.(填数字)
(3)经X射线探明,X与W形成化合物的晶体结构与NaCl的晶体结构相似,X2+的配位原子所构成的立体几何构型为___.
(4)往Z的硫酸盐溶液中加入过量氨水,可生成[Z(NH3)4]SO4,下列说法正确的是___.
A.[Z(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(NH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.[Z(NH3)4]SO4组成元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为四面体
(5)固体YCl5的结构实际上是YCl4+和YCl6-构成的离子晶体,其晶体结构与CsCl相似.若晶胞边长为apm,则晶胞的密度为___g•cm-3.(已知阿伏伽德罗常数为NA,用含a和NA的代数式表示)
▼优质解答
答案和解析
R、W、X、Y、Z是周期表中前四周期元素,它们的原子序数依次递增.R的基态原子中占据哑铃形原子轨道的电子数为1,及p能级只有1个电子,R原子核外电子排布为1s22s22p1,故R为硼元素;Y元素原子的3p能级处于半充满状态,Y原子的核外电子排布为1s22s22p63s23p3,故Y为磷元素;W的氢化物的沸点比同族其它元素氢化物的沸点高,考虑氢键的存在,且X2+与W2-具有相同的电子层结构,故X处于第三周期、W处于第二周期,故X为Mg元素、W为氧元素;Z+的电子层都充满电子,各层电子数为2、8、18,故Z原子核外电子数为2+8+18+1=29,故Z为Cu元素,
(1)Z为Cu元素,原子核外电子数为29,原子核外电子排布式为1s22s22p63s23p63d104s1,Cu的基态原子的外围电子排布式为3d104s1,
故答案为:3d104s1;
(2)H原子成1个键,O原子成2个键,B原子一般是形成3个键,B形成4个键,其中1个键很可能就是配位键,则成3个键的B原子为SP2杂化,成4个键的B为SP3杂化;
观察模型,可知Am-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,
故答案为:SP2、SP3;2;
(3)经X射线探明,Mg与O形成化合物的晶体结构与NaCl的晶体结构相似,Mg2+的周围有6个O原子,为如图结构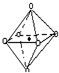 ,故配位原子所构成的立体几何构型为正八面体,
,故配位原子所构成的立体几何构型为正八面体,
故答案为:正八面体;
(4)A.[Z(NH3)4]SO4中,内界离子[Cu(NH3)4]2+与外界离子SO42形成离子键,Cu2+与NH3形成配位键,NH3中N原子与H原子之间形成极性键,故A正确;
B.在[Z(NH3)4]SO4中Z2+提供空轨道,NH3给出孤对电子,故B错误;
C.[Z(NH3)4]SO4组成元素中第一电离能最大的是N元素,故C错误;
D.SO42-与PO43-互为等电子体,价层电子总数相同,空间结构相同,SO42-中S原子成4个σ键,孤对电子对数为
=0,价层电子对为4,为正四面体,故D正确;
故答案为:AD;
(5)固体PCl5的结构实际上是PCl4+和PCl6-构成的离子晶体,其晶体结构与CsCl相似,则晶胞的组成为P2Cl10,晶胞中相当于含有2个PCl5,若晶胞边长为apm,则晶胞的密度为
=
g•cm-3,
故答案为:
.
(1)Z为Cu元素,原子核外电子数为29,原子核外电子排布式为1s22s22p63s23p63d104s1,Cu的基态原子的外围电子排布式为3d104s1,
故答案为:3d104s1;
(2)H原子成1个键,O原子成2个键,B原子一般是形成3个键,B形成4个键,其中1个键很可能就是配位键,则成3个键的B原子为SP2杂化,成4个键的B为SP3杂化;
观察模型,可知Am-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,
故答案为:SP2、SP3;2;
(3)经X射线探明,Mg与O形成化合物的晶体结构与NaCl的晶体结构相似,Mg2+的周围有6个O原子,为如图结构
 ,故配位原子所构成的立体几何构型为正八面体,
,故配位原子所构成的立体几何构型为正八面体,故答案为:正八面体;
(4)A.[Z(NH3)4]SO4中,内界离子[Cu(NH3)4]2+与外界离子SO42形成离子键,Cu2+与NH3形成配位键,NH3中N原子与H原子之间形成极性键,故A正确;
B.在[Z(NH3)4]SO4中Z2+提供空轨道,NH3给出孤对电子,故B错误;
C.[Z(NH3)4]SO4组成元素中第一电离能最大的是N元素,故C错误;
D.SO42-与PO43-互为等电子体,价层电子总数相同,空间结构相同,SO42-中S原子成4个σ键,孤对电子对数为
| 6+2-4×2 |
| 2 |
故答案为:AD;
(5)固体PCl5的结构实际上是PCl4+和PCl6-构成的离子晶体,其晶体结构与CsCl相似,则晶胞的组成为P2Cl10,晶胞中相当于含有2个PCl5,若晶胞边长为apm,则晶胞的密度为
| ||
| (a×10-10cm)3 |
| 417×1030 |
| a3NA |
故答案为:
| 417×1030 |
| a3NA |
看了 周期表中前四周期元素R、W、...的网友还看了以下:
元素A-D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题.(1)上表中与A属于同一周期 2020-04-08 …
欧洲大型强子对撞机(LargeHadronCollider)简称LHC,于2009年9月重新启动, 2020-04-08 …
化学实验方法中中的实验周期问题”试样放在溶液中4h,2个实验周期“是什么意思?比如说第一个周期则么 2020-05-02 …
《荀子·儒效篇》记载,周初“立七十一国,姬姓独居五十三人”。这说明①周的封国中,周王亲属做诸侯的居 2020-06-21 …
《荀子》一书中写道:“(周公)兼制天下,立七十一国,姬姓独居五十三人。”材料表明,周初最受周天子信 2020-07-13 …
文中哪些词语表明周团长选择死亡是经过深思熟虑的?处于极度饥饿中的周团长和战士互相推让炒面,表现了他 2020-07-15 …
有谁知道中秋节的由来与传说中秋节有悠久的历史,和其它传统节日一样,也是慢慢发展形成的,古代帝王有春 2020-07-25 …
下面是《雷雨》中周朴园和鲁侍萍重逢时周朴园的语言,请用四个恰当的词语描述周朴园的心理变化过程。周朴园 2020-12-02 …
《荀子·儒教》记载:周初“立七十一国,姬姓独居五十三人”。这说明①周的封国中,周王亲属做诸侯的居多② 2020-12-12 …
某行星自转周期为T,赤道半径为R,研究发现若该行星自转角速度变为原来两倍将导致该星球赤道上物体将恰好 2020-12-14 …