早教吧作业答案频道 -->化学-->
以菱锰矿(主要成分MnCO3,含有铁、镍、钴等的碳酸盐杂质)为原料生产金属锰的工艺流程简化表示如下:已知:①MnCO3(s)+H2SO4(aq)⇌MnSO4(aq)+CO2(g)+H2O(1)△H<0②Fe(OH)3完全沉
题目详情
以菱锰矿(主要成分MnCO3,含有铁、镍、钴等的碳酸盐杂质)为原料生产金属锰的工艺流程简化表示如下: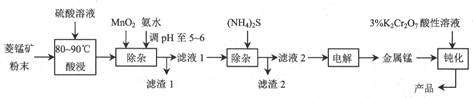
已知:
①MnCO3(s)+H2SO4(aq)⇌MnSO4(aq)+CO2(g)+H2O(1)△H<0
②Fe(OH)3完全沉淀的pH为3.7,Mn(OH)2、Co(OH)2、Ni(OH)2、Fe(OH)2开始沉淀的pH均大于7
③25℃,Ksp(MnS)=2.5×10-10,Ksp(CoS)=4×10-21,Ksp(NiS)=3.2×10-19
回答下列问题:
(1)酸浸时控制温度为80~90℃,原因是___.
(2)浸出液中先加入MnO2的目的是氧化Fe2+,反应的离子方程式为___,再加入氨水调节pH至5~6的作用是___.
(3)滤渣2的主要成分是___;利用(NH4)2S除杂易产生H2S,危害生产人员的健康,可用二乙基二硫代氨基甲酸钠(DDTC)代替(NH4)2S.
已知:25℃,Ksp[Ni(DDTC)2]=7.94×10-14,电解液中Ni2+的最大允许浓度为1.70×10-5mol•L-1,若某电解液中c(DDTC-)=8.00×10-5mol•L-1,则该电解液中的c(Ni2+)___(填“是”、“否”)符合Ni2+的最大允许浓度要求.
(4)电解时,阴极发生主要反应的电极反应式为___,由于发生副作用,阴极上会产生少量气体,其分子式为___.
(5)为增强电解所得金属锰的抗腐蚀性,可用3%的K2Cr2O7酸性溶液钝化处理,还原产物为Cr3+,假定钝化层的化学成分为MnOx,则该反应的离子方程式为___.

已知:
①MnCO3(s)+H2SO4(aq)⇌MnSO4(aq)+CO2(g)+H2O(1)△H<0
②Fe(OH)3完全沉淀的pH为3.7,Mn(OH)2、Co(OH)2、Ni(OH)2、Fe(OH)2开始沉淀的pH均大于7
③25℃,Ksp(MnS)=2.5×10-10,Ksp(CoS)=4×10-21,Ksp(NiS)=3.2×10-19
回答下列问题:
(1)酸浸时控制温度为80~90℃,原因是___.
(2)浸出液中先加入MnO2的目的是氧化Fe2+,反应的离子方程式为___,再加入氨水调节pH至5~6的作用是___.
(3)滤渣2的主要成分是___;利用(NH4)2S除杂易产生H2S,危害生产人员的健康,可用二乙基二硫代氨基甲酸钠(DDTC)代替(NH4)2S.
已知:25℃,Ksp[Ni(DDTC)2]=7.94×10-14,电解液中Ni2+的最大允许浓度为1.70×10-5mol•L-1,若某电解液中c(DDTC-)=8.00×10-5mol•L-1,则该电解液中的c(Ni2+)___(填“是”、“否”)符合Ni2+的最大允许浓度要求.
(4)电解时,阴极发生主要反应的电极反应式为___,由于发生副作用,阴极上会产生少量气体,其分子式为___.
(5)为增强电解所得金属锰的抗腐蚀性,可用3%的K2Cr2O7酸性溶液钝化处理,还原产物为Cr3+,假定钝化层的化学成分为MnOx,则该反应的离子方程式为___.
▼优质解答
答案和解析
(1)酸浸时控制温度为80~90℃,原因是温度过低反应速率小,温度过高反应①平衡逆向移动,锰元素的浸出率降低,
故答案为:温度过低反应速率小,温度过高反应①平衡逆向移动,锰元素的浸出率降低;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是据得失电子守恒有MnO2+2Fe2+-Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+-Mn2++2Fe3+,最后据原子守恒得,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,再加入氨水调节pH至5~6的作用是沉淀铁离子生成氢氧化铁沉淀,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;使Fe3+转化为Fe(OH)3沉淀;
(3)由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;
故答案为:CoS和NiS;
(4)由于第二次过滤后的滤液中主要含有NiSO4,电解该溶液时Ni2+在阴极上被还原:Mn2++2e-=Mn,阴极上溶液中的氢离子得到电子生成氢气,
故答案为:Mn2++2e-=Mn;H2;
(5)用3%的K2Cr2O7酸性溶液钝化处理,还原产物为Cr3+,假定钝化层的化学成分为MnOx,发生的反应是重铬酸钾氧化锰离子生成MnOx,结合电荷守恒和原子守恒配平书写离子方程式为:xCr2O72-+3Mn2++8xH+=2xCr3++3MnOx+4xH2O,
故答案为:xCr2O72-+3Mn2++8xH+=2xCr3++3MnOx+4xH2O.
故答案为:温度过低反应速率小,温度过高反应①平衡逆向移动,锰元素的浸出率降低;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是据得失电子守恒有MnO2+2Fe2+-Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+-Mn2++2Fe3+,最后据原子守恒得,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,再加入氨水调节pH至5~6的作用是沉淀铁离子生成氢氧化铁沉淀,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;使Fe3+转化为Fe(OH)3沉淀;
(3)由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;
故答案为:CoS和NiS;
(4)由于第二次过滤后的滤液中主要含有NiSO4,电解该溶液时Ni2+在阴极上被还原:Mn2++2e-=Mn,阴极上溶液中的氢离子得到电子生成氢气,
故答案为:Mn2++2e-=Mn;H2;
(5)用3%的K2Cr2O7酸性溶液钝化处理,还原产物为Cr3+,假定钝化层的化学成分为MnOx,发生的反应是重铬酸钾氧化锰离子生成MnOx,结合电荷守恒和原子守恒配平书写离子方程式为:xCr2O72-+3Mn2++8xH+=2xCr3++3MnOx+4xH2O,
故答案为:xCr2O72-+3Mn2++8xH+=2xCr3++3MnOx+4xH2O.
看了 以菱锰矿(主要成分MnCO3...的网友还看了以下:
连字成词(英语)l u o e b s r u s r e t o s w a e s r t e 2020-05-14 …
用所给字母拼成单词.1.a,l,a,d,s.2.a,d,o,s.3.c,o,r,p,n用所给字母拼 2020-05-15 …
u,i,n,c,o,s可以拼成什么单词?还有,o,s,l,h,u,d还有,t,p.s.n.e.r, 2020-05-23 …
A.根据释义,拼写单词.1.costingalotofmoneyx,p,s,i,e,e,e,n,v 2020-06-10 …
.已知:Kps(ZnS)=1.2×10-23,Ksp(MnS)=1.4×10-15则()A.ϕo( 2020-06-11 …
英语中S+V+P,S+V,S+V+O,S+V+O+O和S+V+O+C句型是指什么? 2020-06-12 …
英语中,S+V+P,S+V,S+V+O,S+V+INO+DO,S+V+O+OC,这些个表示什么? 2020-07-24 …
判断下列句子属于5种类型基本句型中的哪种类型用(S+V)(S+V+P)(S+V+O)(S+V+INO 2020-11-01 …
1、在番茄中,圆形(O)对长形(o)是显性,单一花序(S)对复状花序(s)是显性.这两对基因是连锁的 2020-12-05 …
S.O.S的名词解释是什么?S.O.S的名词解释是什么?书上说的什么需要时(限用1次),临时医嘱:1 2020-12-14 …