早教吧作业答案频道 -->化学-->
食盐是日常生活的必需品,也是重要的化工原料.粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、7
题目详情
食盐是日常生活的必需品,也是重要的化工原料.
粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳.实验室提纯NaCl的流程如图1:
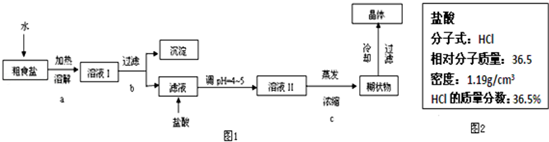
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,从实验室提供的试剂中选出,按滴加顺序依次为___
(2)请写出下列试剂加入时发生反应的离子反应方程式:
加入试剂i:___;
加入试剂iii:___、___.
(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为___.(从提供的试剂中选)
(4)实验中用到的盐酸的物质的量浓度为0.400mol/L,现实验室某浓盐酸试剂瓶上的有关数据如图2:
欲用图2所述的浓盐酸配制实验所需浓度的稀盐酸480mL,
①配制需要的玻璃仪器有烧杯、玻璃棒、胶头滴管、___、___(填仪器名称)
②需量取的浓盐酸的体积为:___.
粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳.实验室提纯NaCl的流程如图1:

(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,从实验室提供的试剂中选出,按滴加顺序依次为___
(2)请写出下列试剂加入时发生反应的离子反应方程式:
加入试剂i:___;
加入试剂iii:___、___.
(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为___.(从提供的试剂中选)
(4)实验中用到的盐酸的物质的量浓度为0.400mol/L,现实验室某浓盐酸试剂瓶上的有关数据如图2:
欲用图2所述的浓盐酸配制实验所需浓度的稀盐酸480mL,
①配制需要的玻璃仪器有烧杯、玻璃棒、胶头滴管、___、___(填仪器名称)
②需量取的浓盐酸的体积为:___.
▼优质解答
答案和解析
在溶液Ⅰ中可依次加入氢氧化钠、氯化钡、饱和碳酸钠溶液,过滤所得滤液含有氯化钠、氢氧化钠和碳酸钠,加入盐酸,所得溶液Ⅱ为氯化钠,蒸发浓缩,冷却结晶可得到氯化钠晶体.
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,应首先加入过量的氢氧化钠除去镁离子和三价铁离子,然后加入过量的氯化钡可以除去硫酸根离子,最后加入过量的饱和碳酸钠溶液除去过量的钡离子和钙离子,
故答案为:NaOH溶液,BaCl2溶液,饱和Na2CO3溶液;
(2)加入氢氧化钠后氢氧根离子与镁离子反应生成氢氧化镁沉淀,离子方程式为:Mg2++2OH-=Mg(OH)2↓,
加入碳酸钠后,钙离子与碳酸根离子反应生成碳酸钙沉淀,离子方程式为:Ba2++CO32-=BaCO3↓;
钡离子与碳酸根离子反应生成碳酸钡沉淀,离子方程式:Ca2++CO32-=CaCO3↓;
故答案为:Mg2++2OH-=Mg(OH)2↓;Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓;
(3)除去NaCl晶体表面的少量的KCl,应选用75%的乙醇,因为CCl4有毒,同时KCl也不会溶解在CCl4中,
故答案为:75%乙醇;
(4)①用浓溶液配制烯溶液的步骤为:计算出需要的浓盐酸的体积16.8ml,用20ml量筒量取所需要的浓盐酸的体积,在烧杯中稀释(可用量筒量取水),用玻璃棒搅拌,冷却后转移到500ml容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀,所以还需要的玻璃仪器有:20mL量筒、胶头滴管、玻璃棒、烧杯、500mL容量瓶;
故答案为:20mL量筒;500mL容量瓶;
②从浓盐酸试剂瓶上的有关数据可知盐酸的密度为1.19g/ml,质量分数为36.5%,摩尔质量为36.5g/mol,
依据C=
,该浓盐酸的物质的量浓度为:C=
mol/L=11.9mol/L,稀释前后溶液中所含的氯化氢的物质的量不变,设消耗浓盐酸的体积为Vml,则11.9mol/L×V=0.400mol/L×500ml,解得V=16.8ml,
故答案为:16.8mL.
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,应首先加入过量的氢氧化钠除去镁离子和三价铁离子,然后加入过量的氯化钡可以除去硫酸根离子,最后加入过量的饱和碳酸钠溶液除去过量的钡离子和钙离子,
故答案为:NaOH溶液,BaCl2溶液,饱和Na2CO3溶液;
(2)加入氢氧化钠后氢氧根离子与镁离子反应生成氢氧化镁沉淀,离子方程式为:Mg2++2OH-=Mg(OH)2↓,
加入碳酸钠后,钙离子与碳酸根离子反应生成碳酸钙沉淀,离子方程式为:Ba2++CO32-=BaCO3↓;
钡离子与碳酸根离子反应生成碳酸钡沉淀,离子方程式:Ca2++CO32-=CaCO3↓;
故答案为:Mg2++2OH-=Mg(OH)2↓;Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓;
(3)除去NaCl晶体表面的少量的KCl,应选用75%的乙醇,因为CCl4有毒,同时KCl也不会溶解在CCl4中,
故答案为:75%乙醇;
(4)①用浓溶液配制烯溶液的步骤为:计算出需要的浓盐酸的体积16.8ml,用20ml量筒量取所需要的浓盐酸的体积,在烧杯中稀释(可用量筒量取水),用玻璃棒搅拌,冷却后转移到500ml容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀,所以还需要的玻璃仪器有:20mL量筒、胶头滴管、玻璃棒、烧杯、500mL容量瓶;
故答案为:20mL量筒;500mL容量瓶;
②从浓盐酸试剂瓶上的有关数据可知盐酸的密度为1.19g/ml,质量分数为36.5%,摩尔质量为36.5g/mol,
依据C=
| 1000ρw |
| M |
| 1000×1.19×36.5% |
| 36.5 |
故答案为:16.8mL.
看了 食盐是日常生活的必需品,也是...的网友还看了以下:
有100g10%的食盐溶液使其质量分数变为20%有三种方法填空与质量分数大于20%的浓食盐溶液混合与 2020-03-31 …
现有100g溶质质量分数为20%的食盐溶液,和200g溶质质量分数为10%的食盐溶液,混合后所得溶 2020-04-09 …
关于盐溶液盐溶液的水解里电荷守恒和质子守恒,物料守恒怎么理解?例如:碳酸钠溶液,电荷守恒时为什么碳 2020-05-13 …
在电解食盐水之前,需要提纯食盐水.为了除去粗盐中的Ca3+、Mg3+、SOy3-及泥沙,可将粗盐溶 2020-05-14 …
海水晒盐得到粗盐,剩余的母液称为苦卤,粗盐和苦卤用途广泛.(1)为了除去粗盐溶液中的Ca2+、Mg 2020-05-16 …
盐溶液蒸干后的产物盐类在水中是以离子的形式存在的,也就是说在NaCl和KNO3的溶液中会有钠离子、 2020-05-17 …
将食盐的饱和溶液在温度不变的条件下蒸发水分,下列说法正确的是A溶质的质量减少B溶液的质量分数增大C 2020-05-23 …
下列关于溶液的说法不正确的是()A.溶液是均一,稳定的混合物B.生理盐水、碘酒、蒸馏水都属于溶液C 2020-06-03 …
请解释一下下面的高中溶解性口诀的3、5句具体意思!钾钠铵盐硝酸盐,全部溶解不困难,碳硅亚硫磷酸盐, 2020-06-06 …
酸碱盐溶解性口诀的疑问钾钠铵盐硝酸盐,都能溶于水中间,盐酸除了银和汞,硫酸难溶是钡铅.碳酸磷酸不多 2020-06-09 …