近年来大气问题受到人们越来越多的关注.按要求回答下列问题:Ⅰ.实现反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义.
近年来大气问题受到人们越来越多的关注.按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义.在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图1.
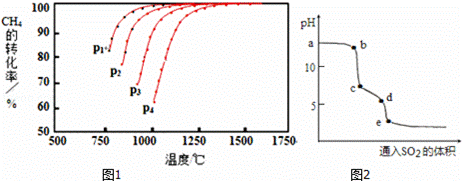
则p1、p2、p3、p4由大到小的顺序 P4>P3>P2>P1 ,该反应的正反应是 吸热 (填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K= 1024 .
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJ•mol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJ•mol﹣1
CH4(g)+2NO2 (g)=N2(g)+CO2(g)+2H2O(g)△H3
则△H3= ﹣867kJ•mol﹣1 ,如果三个反应的平衡常数依次为K1、K2、K3,则K3= 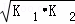 (用K1、K2表示)
(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol•L﹣1NaOH溶液通入SO2过程中的pH变化曲线如图2所示.
①ab段发生反应的离子方程式为 SO2+2OH﹣=SO32﹣+H2O .
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为 c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣) ,如果NaHSO3的水解平衡常数Kh=1×10﹣12mol•L﹣1,则该温度下H2SO3的第一步电离平衡常数Ka= 10﹣2mol•L﹣1 .
考点:
转化率随温度、压强的变化曲线;用盖斯定律进行有关反应热的计算;化学平衡常数的含义;离子浓度大小的比较..
专题:
化学反应中的能量变化;化学平衡专题;电离平衡与溶液的pH专题.
分析:
Ⅰ、由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),据此结合方程式判断压强对平衡移动的影响进行解答; 由图1可知,压强为P4、1100℃的条件下,该反应5min时达到平衡X点,是甲烷的转化率为80%,据此计算甲烷的浓度变化量,利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算该温度下的平衡常数; Ⅱ、(1)依据已知的热化学方程式利用盖斯定律解答; (2)①向20mL0.1mol•L﹣1NaOH溶液通入SO2过程中首先发生SO2+2OH﹣=SO32﹣+H2O,其次发生SO2+SO32﹣+H2O=2HSO3﹣;据此分析; ②d点时溶液中溶质为NaHSO3,HSO3﹣电离大于水解溶液呈酸性;H2SO3的第一步电离平衡常数Ka=,NaHSO3的水解平衡常数Kh=,据此分析.
Ⅰ、由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1,由图可知,压强一定时,温度越高甲烷的转化率越大,说明升温平衡向正反应方向移动,所以正反应为吸热反应;由图1可知,当1000℃甲烷的转化率为80%时, CH4(g)+CO2(g)=2CO(g)+2H2(g), 开始(mol/L):2.5 2.5 0 0 变化(mol/L):2.5×80%=2 2 4 4 平衡(mol/L):0.5 0.5 4 4 该温度下平衡常数k==1024; 故答案为:P4>P3>P2>P1;吸热,1024; Ⅱ.(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ•mol﹣1 ②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ•mol﹣1 由盖斯定律(①+②)÷2得到CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ•mol﹣1,如果三个反应的平衡常数依次为K1、K2、K3,则K3= ,故答案为:﹣867kJ•mol﹣1;; (2)①向20mL0.1mol•L﹣1NaOH溶液通入SO2过程中首先发生SO2+2OH﹣=SO32﹣+H2O,其次发生SO2+SO32﹣+H2O=2HSO3﹣;所以ab段发生反应的离子方程式为SO2+2OH﹣=SO32﹣+H2O,故答案为:SO2+2OH﹣=SO32﹣+H2O; ②d点时溶液中溶质为NaHSO3,HSO3﹣电离大于水解溶液呈酸性,所以溶液中离子浓度由大到小的顺序为c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣);H2SO3的第一步电离平衡常数Ka=,NaHSO3的水解平衡常数Kh=,所以Ka==10﹣2 mol•L﹣1, 故答案为:c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣),10﹣2 mol•L﹣1.
点评:
本题考查反应热的计算、平衡图象及其平衡常数的计算、溶液中的离子浓度的比较等,题目综合性较大,难度中等.
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减 2020-05-13 …
为什么说温度降低增大压强分子平均碰撞频率一定增大?根据z=根号2nπd平方v,温度减小v减小,不是 2020-05-14 …
薯条炸鸡披萨因为水蒸汽变软问题请问如果在一个密闭高温箱内将箱内温度加热至高于50度是不是会大大减缓 2020-07-01 …
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减 2020-07-21 …
天然气是清洁能源,有报道说,使用天然气对于提高人的生活质量有以下好处:①可以有效减少大气污染,提高 2020-07-29 …
下列说法正确的是()A.北半球等温线数值由北向南递减B.南半球等温线数值由南向北递减C.气温大致由低 2020-11-02 …
下图为某海拔1200M的山坡1月和7月平均气温垂直变化图。读图回答第19~20题。19.关于该山坡气 2020-11-10 …
恒温恒压下化学平衡的相关问题举个例子就像恒温恒压N2+3H2=2NH3,已经达到平衡后再充入一摩尔N 2020-11-28 …
粮食问题是当今世界面临的重大问题,造成粮食危机的主要原因是()A.粮食减产,光合作用效率下降B.粮食 2020-12-03 …
深秋、初冬时节是该地大雾的多发期,这其中的道理是()A.昼夜温差减小,水汽易凝结,但风力微弱,水汽不 2020-12-07 …