早教吧作业答案频道 -->化学-->
硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:Ⅰ、硫酸铜的制备(1)某学习小组同学利用铜屑、稀硫酸为原料制备硫酸铜.其原理是在高温条件下将铜粉
题目详情
 硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:
硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:Ⅰ、硫酸铜的制备
(1)某学习小组同学利用铜屑、稀硫酸为原料制备硫酸铜.其原理是在高温条件下将铜粉反复灼烧,使铜充分氧化成氧化铜,再将氧化铜与稀硫酸反应制备硫酸铜,请写出相应的化学方程式________、________;
(2)通过查阅资料,同学们找到了一种工业制备硫酸铜晶体(CuSO 4 ?xH 2 O)的流程,具体如下:将铜丝放到稀硫酸中,控温在50℃.加入10%的H 2 O 2 ,反应0.5h后,升温到60℃,持续反应1h后,过滤、蒸发、降温结晶等,用少量95%的酒精淋洗后晾干,得CuSO 4 ?5H 2 O.
①写出该工艺流程生成CuSO 4 的化学方程式________;
②在上述生产过程中,控制温度在50℃和60℃加热的原因为________,
③上述生产流程的优点有________(写出一种即可);
④在过滤时,采用了右图所示的装置,你认为这样做的优点是________;
Ⅱ、硫酸铜的应用及相关实验
(1)波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,其有效成分是Cu 4 (OH) 6 SO 4 ,其中铜元素的化合价为________,该化学式可以写成盐和碱的形式________,其杀菌机理可看作是Cu 2+ 使病原菌失去活性,这说明病原菌的主体是________(填一种有机物名称).
(2)为验证Al的化学性质比铜活泼,小怡做了以下实验,现象如下表:
| Al片(未打磨) | Al片(打磨) | |
| CuSO 4 溶液 (5%,5mL) | 无变化,数小时后铝片上附有极少气泡,几乎无红色物质 | 极少气泡,附着极少红色物质,持续较长时间 |
| CuSO 4 溶液 (10%,5mL) | 无变化,数小时后铝片附有稍多气泡,仅有极少红色斑点 | 稍多气泡,附着极少(多于5%)红色物质,持续较长时间 |
| CuCl 2 溶液 (5%,5mL) | 多量气泡,迅速出现红色物质,很快溶液变成无色,且温度升高 | 更多量气泡,迅速出现红色物质,很快溶液变成无色,且温度升高 |
①铝和铜盐溶液反应速率与________、________和________有关,同时说明铜盐溶液中的Cl - 能________(填“加快”或“抑制”)反应速率,若实验室没有CuCl 2 溶液,则可以在CuSO 4 溶液中加入少许________(填物质名称),以使实验现象更为明显;
②该反应过程要________(填“吸热”或“放热”).经检验,产生的气体是一种能燃烧的单质,该气体是________(填化学式);
Ⅲ、硫酸铜晶体(CuSO 4 ?xH 2 O)中结晶水(xH 2 O)含量的测定
在老师的指导下,学习小组取12.5g硫酸铜晶体(CuSO 4 ?xH 2 O)进行热分解,获得相关数据,并绘制成固体质量-温度的关系如下图.
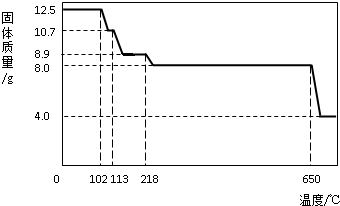
(1)在加热过程中,随着水分的蒸发,固体颜色将由蓝色逐渐变为________色,最终变为黑色;
(2)写出固体质量由10.7g变为8.9g时的化学方程式________;
(3)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为________;
(4)根据图中数据,计算CuSO 4 ?xH 2 O中的CuSO 4 的质量分数.(要求:根据x的值进行计算,CuSO 4 的相对分子质量:160,H 2 O的相对分子质量:18)
▼优质解答
答案和解析
Ⅰ(1)铜和氧气反应生成氧化铜,氧化铜和硫酸反应生成硫酸铜和水,化学方程式分别为2Cu+O2 2CuO、CuO+H2SO4=CuSO4+H2O;(2)①铜和过氧化氢以及硫酸反应生成硫酸铜和水,化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O;②H2O2受热易分解,温度应该控制在50℃到60℃之间;③从环保角度对两套方案的不同部分进行比较,方案一第一步灼烧会产生污染空气的气体,粉尘,烟雾,由此可知方案2更合理;④在过滤时,采用了右图所示的装置,你认为这样做的优点是加快过滤的速度;Ⅱ(1)由化合物中各元素的代数和为0以及氢氧根的化合价为-1价,硫酸根的化合价为-2价可知Cu4(OH)6SO4,其中铜元素的化合价为+2价;该化学式可以写成盐和碱的形式:CuSO4?3Cu(OH)2;重金属盐能使蛋白质变性,所以杀菌机理可看作是Cu2+使病原菌失去活性,这说明病原菌的主体是蛋白质;(2)①铝和铜盐溶液反应速率与铝片是否打磨、硫酸铜溶液的浓度以及不同的铜盐有关;同时说明铜盐溶液中的Cl-能加快反应速率,若实验室没有CuCl2溶液,则可以在CuSO4溶液中加入少许盐酸;②该反应过程要放热;经检验,产生的气体是一种能燃烧的单质,该气体是氢气,化学式为H2;Ⅲ(1)硫酸铜晶体(CuSO4?xH2O)是蓝色的,失去结晶水后变为白色;(2)硫酸铜晶体(CuSO4?xH2O)是蓝色的,失去结晶水后生成硫酸铜和水,化学方程式CuSO4?xH2O CuSO4+xH2O↑;(3)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为2CuSO42CuO+2SO2↑+O2↑;(4)由图示数据和“到650℃时该固体完全失去结晶水”可知,结晶水的质量为:12.5g-8g=4.5gCuSO4?xH2O CuSO4+xH2O↑.160+18x 18x12.5g 4.5gx=5CuSO4?5H2O中的CuSO4的质量分数=×100%=64%答:CuSO4?xH2O中的CuSO4的质量分数为64%.故答案为:Ⅰ(1)2Cu+O2 2CuO;CuO+H2SO4=CuSO4+H2O;(2)①Cu+H2O2+H2SO4=CuSO4+2H2O;②防止H2O2受热分解;③耗能少;④加快过滤的速度;Ⅱ(1)+2价;CuSO4?3Cu(OH)2;蛋白质;(2)①铝片是否打磨;硫酸铜溶液的浓度;不同的铜盐;加快;盐酸;②放热;H2;Ⅲ(1)白;(2)CuSO4?xH2O CuSO4+xH2O↑;(3)2CuSO42CuO+2SO2↑+O2↑;(4)64%.
分析:
Ⅰ(1)根据铜和氧气反应生成氧化铜以及氧化铜和硫酸反应生成硫酸铜和水进行解答;(2)根据铜和过氧化氢以及硫酸反应生成硫酸铜和水、从环保角度对两套方案的不同部分进行比较进行解答;Ⅱ(1)根据化合物中各元素的代数和为0以及重金属盐能使蛋白质变性进行解答;(2)根据铝和铜盐溶液反应速率与铝片是否打磨、硫酸铜溶液的浓度以及不同的铜盐有关进行解答;Ⅲ根据硫酸铜晶体(CuSO4?xH2O)是蓝色的,失去结晶水后变为白色,然后设计提取的有关问题;最后考查学生的计算能力.
点评:
该题为硫酸铜的知识为线索,考查了多方面的知识,难度较大.
分析:
Ⅰ(1)根据铜和氧气反应生成氧化铜以及氧化铜和硫酸反应生成硫酸铜和水进行解答;(2)根据铜和过氧化氢以及硫酸反应生成硫酸铜和水、从环保角度对两套方案的不同部分进行比较进行解答;Ⅱ(1)根据化合物中各元素的代数和为0以及重金属盐能使蛋白质变性进行解答;(2)根据铝和铜盐溶液反应速率与铝片是否打磨、硫酸铜溶液的浓度以及不同的铜盐有关进行解答;Ⅲ根据硫酸铜晶体(CuSO4?xH2O)是蓝色的,失去结晶水后变为白色,然后设计提取的有关问题;最后考查学生的计算能力.
点评:
该题为硫酸铜的知识为线索,考查了多方面的知识,难度较大.
看了 硫酸铜是生产、生活中常见的物...的网友还看了以下:
影响化学反应速率的因素很多,某化学兴趣小组进行化学反应速率影响因素的探究实验:KI在经酸化的溶液中 2020-04-09 …
化学硫酸铜结晶水计算题,求教硫酸铜在30度时溶解度为25g,60度时为30g,现将60度的硫酸铜饱 2020-05-13 …
下列有关酶的叙述,正确的是()A.组成酶的基本单位都是氨基酸B.低温、高温、过酸、过碱都会使酶变性 2020-05-14 …
下列有关酶的叙述,正确的是A.酶只能在生物体内发挥作用B.组成酶的基本单位都是氨基酸C.低温、高温 2020-05-14 …
学习酸碱中和反应时,甲乙两同学对其产生探究兴趣(1)甲同学将稀硫酸慢慢滴加入装有氢氧化钠溶液的烧杯 2020-05-14 …
雯雯在自学碳酸钠性质时,查到了以下资料:①CO2+Na2CO3+H2O═2NaHCO3,CO2通入 2020-06-12 …
(2010•十堰)小丹同学在学习酸的性质时,从同一卷镁带中剪取相等的两根镁带,分别与室温下H+浓度 2020-07-12 …
温度和酸碱盐pH值的关系是?我的理解是。。强酸是完全电离的,若室温下有一强酸溶液pH=2,则c(H+ 2020-11-03 …
初三化学~~!碳酸钠溶液与稀盐酸反应是放热还是吸热?那碳酸钠固体与稀盐酸反应呢?说明一下理由!不对呀 2020-11-05 …
[实验化学]磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电 2020-12-22 …