早教吧作业答案频道 -->化学-->
下面是同学们测定黄铜(铜锌合金)中铜的质量分数的过程.(1)小华同学取10g黄铜,加入足量的稀硫酸,共收集到气体0.2g,则黄铜中铜的质量分数是多少?(写出计算过程)(2)小婷同
题目详情
下面是同学们测定黄铜(铜锌合金)中铜的质量分数的过程.
(1)小华同学取10g黄铜,加入足量的稀硫酸,共收集到气体0.2g,则黄铜中铜的质量分数是多少?(写出计算过程)
(2)小婷同学另取10g黄铜于烧杯中,向烧杯中加入稀硫酸,测得加入的稀硫酸质量和烧杯中剩余物的质量如下表:
①表中m=___,从表中的数据分析,当小婷同学加入___g稀硫酸时,烧杯中刚好没有气泡产生.
②请在下图画出10g黄铜加入稀硫酸与生成氢气的质量的图象.
(1)小华同学取10g黄铜,加入足量的稀硫酸,共收集到气体0.2g,则黄铜中铜的质量分数是多少?(写出计算过程)
(2)小婷同学另取10g黄铜于烧杯中,向烧杯中加入稀硫酸,测得加入的稀硫酸质量和烧杯中剩余物的质量如下表:
| 加入稀硫酸的质量/g | 30 | 60 | 90 | 120 |
| 烧杯中剩余物的质量/g | 39.94 | m | 99.82 | 129.8 |
②请在下图画出10g黄铜加入稀硫酸与生成氢气的质量的图象.

▼优质解答
答案和解析
(1)设参与反应的锌的质量为x,
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
=
解得:x=6.5g
则样品中铜的质量分数为:
×100%=35%
答:该样品中铜的质量分数为35%.
(2)①由表中数据分析每消耗30g稀硫酸,生成氢气的质量为10g+30g-39.94g=0.06g,当加入90g稀硫酸时,生成气体的质量为10g+90g-99.82g=0.18g,说明90g稀硫酸完全消耗,所以消耗60g稀硫酸,生成氢气的质量为10+60-m=0.12,m=69.88,当加入120g稀硫酸时,生成气体的质量为10g+120g-129.8g=0.2g,所以消耗稀硫酸质量为
=100g.故填:69.88;100;
②根据恰好反应时,生成氢气0.2g,消耗稀硫酸100g,反应完前后气体质量不再增加,可得: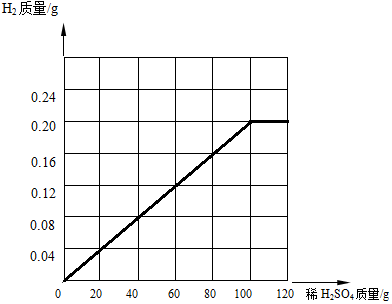 .
.
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
| 65 |
| x |
| 2 |
| 0.2g |
解得:x=6.5g
则样品中铜的质量分数为:
| 10g-6.5g |
| 10g |
答:该样品中铜的质量分数为35%.
(2)①由表中数据分析每消耗30g稀硫酸,生成氢气的质量为10g+30g-39.94g=0.06g,当加入90g稀硫酸时,生成气体的质量为10g+90g-99.82g=0.18g,说明90g稀硫酸完全消耗,所以消耗60g稀硫酸,生成氢气的质量为10+60-m=0.12,m=69.88,当加入120g稀硫酸时,生成气体的质量为10g+120g-129.8g=0.2g,所以消耗稀硫酸质量为
| 30g×0.2g |
| 0.06g |
②根据恰好反应时,生成氢气0.2g,消耗稀硫酸100g,反应完前后气体质量不再增加,可得:
 .
.
看了 下面是同学们测定黄铜(铜锌合...的网友还看了以下:
某人把50粒黄豆染色后与一袋黄豆充分混匀,接着抓出100黄豆,数出其中有10粒黄豆被染色,则这袋黄 2020-05-17 …
在日常生活中,人们常用黄豆来生产黄豆芽用作食用,一般1kg黄豆可长出5kg左右豆芽在这一过程(该过 2020-05-17 …
科研人员采用基因工程技术和组织培养技术培育出了“黄金大米”,请据图回答:(1)①过程中需要的酶是, 2020-06-11 …
有一个车间,由红,黄两个故障指示灯表示3台设备的工作情况如一台设备出现故障,则黄就亮;如两台设备出 2020-07-23 …
小明动手在自家封闭的阳台上栽种了一株黄瓜,精心培育一段时间后黄瓜植株上结出了黄瓜,下列表述最合理的是 2020-10-29 …
黄河的知识黄河的形状,流入什么地方,黄河故事,黄河诗句,成语,谚语,歌曲,黄河的现状,提出治理黄河的 2020-11-12 …
(2013•乌鲁木齐)种植能手李大叔种植了一批新品种黄瓜,为了考察这种黄瓜的生长情况,李大叔抽查了部 2020-11-24 …
某人把50粒黄豆染色后与一袋黄豆充分混匀,接着抓出100粒黄豆,数出其中有10粒黄豆被染色,则这袋黄 2020-11-24 …
衣服洗后晾干出现块状黄斑衣服洗后,在晾干过程中暗黄斑出现,貌似不是细菌或者微生物.我问为什么会出现黄 2020-11-24 …
在日常生活中,人们常用黄豆来生产黄豆芽用作食用,一般1kg黄豆可长出5kg左右豆芽在这一过程(该过程 2020-12-14 …