早教吧作业答案频道 -->化学-->
锡(Sn)在自然界中主要以锡石(SnO2)存在,锡石与焦炭在高温条件下可制得金属锡,锡的化合物广泛应用于汽车尾气催化剂,印染媒染剂、色料载体和电镀工业中,锡在化合物中主要以+2
题目详情
锡(Sn)在自然界中主要以锡石(SnO2)存在,锡石与焦炭在高温条件下可制得金属锡,锡的化合物广泛应用于汽车尾气催化剂,印染媒染剂、色料载体和电镀工业中,锡在化合物中主要以+2、+4价存在,某化学兴趣小组设计的由锡石制备SnSO4的合成路线如下:
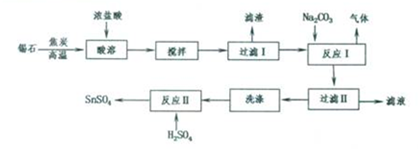
回答下列问题:
(1)Sn2+有强还原性,在酸性条件先易被空气中的O2氧化,反应的离子方程式为:___.
(2)过滤Ⅱ得到的沉淀时SnO,反应Ⅰ的化学方程式是:___;
(3)在洗涤后,检验沉淀是否洗涤干净的方法是:___.
(4)现欲在铁制品表面镀锡,以SnSO4溶液为电解液进行电镀,铁制品应该作___极,该电极反应式为:___.
(5)已知Ksp(SnS)=1×10-25,Ksp(SnS2)=2×10-27,若向含等浓度Sn2+、Sn4+的混合溶液中通入足量的H2S,___先沉淀(填Sn2+或Sn4+),待SnS、SnS2沉淀完全后,溶液中c(S2-)=c mol•L-1,此时
=___.
(6)该兴趣小组通过下列方法测定某金属锡样品的纯度(杂质不参与反应);
①向样品中加入过量的盐酸:Sn+2H+=Sn2++H2↑
②向反应完成的溶液中加入过量的FeCl3:Sn2++2Fe3+=Sn4++2Fe2+;
③用已知浓度的重铬酸钾溶液滴定生成的Fe2+:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
现有金属锡样品0.8000g,经上述各步反应后共用去0.1000mol•L-1 K2Cr2O7溶液20.00mL.则样品中锡的质量分数是___.

回答下列问题:
(1)Sn2+有强还原性,在酸性条件先易被空气中的O2氧化,反应的离子方程式为:___.
(2)过滤Ⅱ得到的沉淀时SnO,反应Ⅰ的化学方程式是:___;
(3)在洗涤后,检验沉淀是否洗涤干净的方法是:___.
(4)现欲在铁制品表面镀锡,以SnSO4溶液为电解液进行电镀,铁制品应该作___极,该电极反应式为:___.
(5)已知Ksp(SnS)=1×10-25,Ksp(SnS2)=2×10-27,若向含等浓度Sn2+、Sn4+的混合溶液中通入足量的H2S,___先沉淀(填Sn2+或Sn4+),待SnS、SnS2沉淀完全后,溶液中c(S2-)=c mol•L-1,此时
| c(Sn2+) |
| c(Sn4+) |
(6)该兴趣小组通过下列方法测定某金属锡样品的纯度(杂质不参与反应);
①向样品中加入过量的盐酸:Sn+2H+=Sn2++H2↑
②向反应完成的溶液中加入过量的FeCl3:Sn2++2Fe3+=Sn4++2Fe2+;
③用已知浓度的重铬酸钾溶液滴定生成的Fe2+:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
现有金属锡样品0.8000g,经上述各步反应后共用去0.1000mol•L-1 K2Cr2O7溶液20.00mL.则样品中锡的质量分数是___.
▼优质解答
答案和解析
SnO2粉末在高温度下与焦炭反应得到金属锡,加浓盐酸进行溶解并过滤得到SnCl2溶液,向其中加碳酸钠,将Sn元素以SnO形式沉淀,过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体;
(1)在酸性条件Sn2+被空气中的O2氧化成Sn4+,发生反应的离子反应方程式为:2Sn2++O2+4H+=2Sn4++2H2O;故答案为:2Sn2++O2+4H+=2Sn4++2H2O;
(2)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑,
故答案为:Sn2++CO32-═SnO↓+CO2↑;
(3)取最后一次洗涤液适量于试管中并滴加稀硝酸酸化,然后滴加硝酸银溶液,无白色沉淀,证明沉淀洗涤干净,若有白色沉淀生成,可证明洗涤液里含有Cl-,沉淀洗涤不干净;故答案为:取最后一次洗涤液适量于试管中并滴加稀硝酸酸化,然后滴加硝酸银溶液,无白色沉淀,证明沉淀洗涤干净;
(4)在铁制品表面镀锡时,阴极为铁,发生电极反应为Sn2++2e-=Sn,故答案为:阴;Sn2++2e-=Sn;
(5)设浓度均为1mol/L的Sn2+、Sn4+的混合溶液中,根据Ksp(SnS)=1×10-25,Ksp(SnS2)=2×10-27,可知SnS开始沉淀时所需要c(S2-)=1×10-25mol/L,SnS2开始沉淀时所需要c(S2-)=
mol/L,故Sn2+最先沉淀;当溶液中c(S2-)=c mol•L-1时,溶液中c(Sn2+)=
;c(Sn4+)=
,则
=
=50c,故答案为:Sn2+;50c;
(6)0.1000mol•L-1 K2Cr2O7溶液20.00mL中Cr2O72-的物质的量为0.1000mol•L-1×0.02L=0.002mol;根据关系式3Sn~6Fe2+~Cr2O72-可知Sn的物质的量为0.002mol×3=0.006mol,则样品的质量分数为
×100%=89.25%,故答案为:89.25%.
(1)在酸性条件Sn2+被空气中的O2氧化成Sn4+,发生反应的离子反应方程式为:2Sn2++O2+4H+=2Sn4++2H2O;故答案为:2Sn2++O2+4H+=2Sn4++2H2O;
(2)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑,
故答案为:Sn2++CO32-═SnO↓+CO2↑;
(3)取最后一次洗涤液适量于试管中并滴加稀硝酸酸化,然后滴加硝酸银溶液,无白色沉淀,证明沉淀洗涤干净,若有白色沉淀生成,可证明洗涤液里含有Cl-,沉淀洗涤不干净;故答案为:取最后一次洗涤液适量于试管中并滴加稀硝酸酸化,然后滴加硝酸银溶液,无白色沉淀,证明沉淀洗涤干净;
(4)在铁制品表面镀锡时,阴极为铁,发生电极反应为Sn2++2e-=Sn,故答案为:阴;Sn2++2e-=Sn;
(5)设浓度均为1mol/L的Sn2+、Sn4+的混合溶液中,根据Ksp(SnS)=1×10-25,Ksp(SnS2)=2×10-27,可知SnS开始沉淀时所需要c(S2-)=1×10-25mol/L,SnS2开始沉淀时所需要c(S2-)=
| 2×10-27 |
| 1×10-25 |
| cmol/L |
| 2×10-27 |
| c2(mol/L) |
| Sn2+ |
| Sn4+ |
| ||
|
(6)0.1000mol•L-1 K2Cr2O7溶液20.00mL中Cr2O72-的物质的量为0.1000mol•L-1×0.02L=0.002mol;根据关系式3Sn~6Fe2+~Cr2O72-可知Sn的物质的量为0.002mol×3=0.006mol,则样品的质量分数为
| 0.006mol×119g/mol |
| 0.800g |
看了 锡(Sn)在自然界中主要以锡...的网友还看了以下:
阅读文段后,回答问题。(5分)我国目前在研的空间实验室采用两舱结构,分别为实验舱和资源舱。实验舱可 2020-04-12 …
______在开发软件时,可用来提高程序员的工作效率。A.程序开发环境B.操作系统的作业管理功能C. 2020-05-23 …
()在开发软件时可用来提高程序员的工作效率。A.程序开发环境B.操作系统的作业管理功能C.编译程序 2020-05-23 …
● 某软件在应用初期运行在 Windows NT 环境中。现该软件需要在 UNIX 环境中运行,而且 2020-05-25 …
● 某软件在应用初期运行在Windows NT 环境中。现因某种原因,该软件需要在UNIX 环境中运 2020-05-26 …
某软件在应用初期运行在Windows NT环境中。现因某种原因,该软件需要在UNIX环境中运行,而且 2020-05-26 …
主要是在分布式异构环境下建立应用系统框架和对象构件,在应用系统框架的支撑下,开发者可以将 2020-05-26 …
1.如果先张法和后张法构件采用相同的张拉控制应力,并设预加应力阶段的预应力损失值也相同,则当构件在 2020-07-05 …
某种型号电子元件在使用的前1000小时内损坏的概率为0.8,现在有10只该电子元件求任取1只电子元 2020-07-22 …
一个完好的铁质工件在使用过程中缺了一块,现用铝给它修完整,修补后的工件质量比原来完好工件少了52克. 2020-11-27 …