早教吧作业答案频道 -->化学-->
中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病.某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3,工艺流程简图如下:
题目详情
中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病.某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3,工艺流程简图如下:
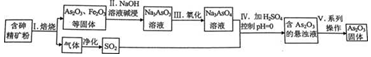
回答下列问题:
(1)过程I中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是___.
A.工业制硫酸 B.漂白纸张 C.自来水消毒
(2)过程II中发生的反应___氧化还原反应(填“是”或“不是”).
(3)过程V中系列操作为___ (填化学实验基本操作名称).
(4)①过程I中焙烧As2S3的化学反应方程式为___.
②过程IV中生成As2O3的离子反应方程式为___.
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-.用石墨为电极,在强碱性溶液中电解含AsO33-的溶液,阳极的电极反应式为___.
(6)测定某As2S3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液l00mL.
b.分别移取25.00mL上述溶液,用0.02500mol•L-1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂).每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二〜图四所示.
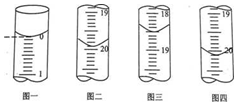
①描述滴定终点的现象___.
②粗产品中As2O3的质量分数为___ (用含有m的代数式表示).

回答下列问题:
(1)过程I中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是___.
A.工业制硫酸 B.漂白纸张 C.自来水消毒
(2)过程II中发生的反应___氧化还原反应(填“是”或“不是”).
(3)过程V中系列操作为___ (填化学实验基本操作名称).
(4)①过程I中焙烧As2S3的化学反应方程式为___.
②过程IV中生成As2O3的离子反应方程式为___.
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-.用石墨为电极,在强碱性溶液中电解含AsO33-的溶液,阳极的电极反应式为___.
(6)测定某As2S3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液l00mL.
b.分别移取25.00mL上述溶液,用0.02500mol•L-1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂).每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二〜图四所示.

①描述滴定终点的现象___.
②粗产品中As2O3的质量分数为___ (用含有m的代数式表示).
▼优质解答
答案和解析
(1)SO2可用于工业制硫酸,漂白纸张,有毒故不能用来消毒自来水;
故答案为:AB;
(2)过程Ⅱ为6NaOH+As2O3=2Na3AsO3+3H2O,元素的化合价没有升降变化,不是氧化还原反应;
故答案为:不是;
(3)过程V为As2O3悬浊液经过过滤、洗涤、干燥的As2O3的过程;
故答案为:过滤、洗涤、干燥;
(4)①过程I中焙烧As2S3的化学反应方程式为:2As2S3+9O2
2As2O3+6SO2;
故答案为:2As2S3+9O2
2As2O3+6SO2;
②过程IV为将二氧化硫与Na3AsO4溶液混合,加入硫酸调节pH为0,生成As2O3的反应,离子反应方程式为:2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O;
故答案为:2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O;
(5)电解时AsO33-变成AsO43-,化合价由+3变为+5,失去2个电子,且为碱性条件,所以阳极反应式为AsO33--2e-+2OH-═AsO43-+H2O;
故答案为:AsO33--2e-+2OH-═AsO43-+H2O;
(6)①I2标准溶液含AsO33-、AsO43-的混合溶液,淀粉做指示剂,终点为:当最后一滴I2标准溶液滴入时,溶液由无色变为蓝色,且半分钟内溶液颜色不再发生变化;
故答案为:当最后一滴I2标准溶液滴入时,溶液由无色变为蓝色,且半分钟内溶液颜色不再发生变化;
②三次滴定,I2标准溶液液面读数如图二〜图四所示,分别消耗标准液19.00mL,18.50mL、20.10mL,第二次数据误差较大,舍去,故平均消耗I2标准溶液为20.00mL,根据
As2O3~AsO33-~I2,则粗产品中As2O3的质量分数为
×100%=
×100%;
故答案为:
×100%.
故答案为:AB;
(2)过程Ⅱ为6NaOH+As2O3=2Na3AsO3+3H2O,元素的化合价没有升降变化,不是氧化还原反应;
故答案为:不是;
(3)过程V为As2O3悬浊液经过过滤、洗涤、干燥的As2O3的过程;
故答案为:过滤、洗涤、干燥;
(4)①过程I中焙烧As2S3的化学反应方程式为:2As2S3+9O2
| ||
故答案为:2As2S3+9O2
| ||
②过程IV为将二氧化硫与Na3AsO4溶液混合,加入硫酸调节pH为0,生成As2O3的反应,离子反应方程式为:2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O;
故答案为:2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O;
(5)电解时AsO33-变成AsO43-,化合价由+3变为+5,失去2个电子,且为碱性条件,所以阳极反应式为AsO33--2e-+2OH-═AsO43-+H2O;
故答案为:AsO33--2e-+2OH-═AsO43-+H2O;
(6)①I2标准溶液含AsO33-、AsO43-的混合溶液,淀粉做指示剂,终点为:当最后一滴I2标准溶液滴入时,溶液由无色变为蓝色,且半分钟内溶液颜色不再发生变化;
故答案为:当最后一滴I2标准溶液滴入时,溶液由无色变为蓝色,且半分钟内溶液颜色不再发生变化;
②三次滴定,I2标准溶液液面读数如图二〜图四所示,分别消耗标准液19.00mL,18.50mL、20.10mL,第二次数据误差较大,舍去,故平均消耗I2标准溶液为20.00mL,根据
| 1 |
| 2 |
0.025mol/L×20×10-3L×
| ||
| m |
| 0.198 |
| m |
故答案为:
| 0.198 |
| m |
看了 中药药剂砒霜(主要成分As2...的网友还看了以下:
1)含2molNaCO3的溶液中含molNa+,有个CO2-..2)含有2.408×10*24个H 2020-04-13 …
1.多少mol硫酸分子与1.806x10*24个水分子含有相同的氧原子数?2.氯化钙溶解于5mol 2020-05-13 …
甲,乙两组人数比是5:3,如果从甲组调14人到乙组,那么,甲,乙两组人数比是1:2.原来甲,乙两组 2020-05-13 …
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.(1)水分子中 2020-05-14 …
乙醇与水的混合物中,乙醇分子(C2H5OH)中所含的氢原子数与水分子中所含的氢原子数相等,则混合物 2020-05-20 …
迷茫ING在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,每3molBrF3中被水 2020-06-06 …
以下名句分别体现了什么哲学观点1.世界的本原是水2.原子和虚空是世界的本原3.寒来则暑往,暑往则寒 2020-06-26 …
已知2个氢原子和一个氧原子化合后能生成水分子,那在水分子中,氢原子组成有无变化生成水分子后,氢原子 2020-06-27 …
有一杯水,连杯重270克.第一次倒出的水比原来杯中的水的一半少3克,第二次倒出的水比余下的34还多 2020-07-17 …
有一杯水,连杯重270克.第一次倒出的水比原来杯中的水的一半少3克,第二次倒出的水比余下的34还多 2020-07-19 …