早教吧作业答案频道 -->化学-->
X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子;M的
题目详情
X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子; M 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反; W为过渡元素,其基态原子外围电子排布成对电子数是未成对电子数4倍.回答下列问题(相关回答均用元素符号表示):
(1)X的基态原子有___种运动状态不同的电子;
(2)ZM3-的离子空间构型为___,其中Z的杂化方式为___;
(3)W的元素符号___W与YM易形成配合物W(YM)4,在W(YM)4中W的化合价为___;与YM分子互为等电子体的离子的化学式为___.
(4)W单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如图A、B所示:
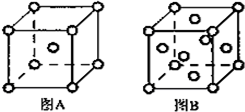
①图B中原子堆积方式为___,A、B中W原子的配位数之比为___.
②A、B晶胞的棱长分别为a cm和b cm,则A、B两种晶体的密度之比为___.
③图A的堆积方式空间利用率___(用含π的式子表示)
(1)X的基态原子有___种运动状态不同的电子;
(2)ZM3-的离子空间构型为___,其中Z的杂化方式为___;
(3)W的元素符号___W与YM易形成配合物W(YM)4,在W(YM)4中W的化合价为___;与YM分子互为等电子体的离子的化学式为___.
(4)W单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如图A、B所示:

①图B中原子堆积方式为___,A、B中W原子的配位数之比为___.
②A、B晶胞的棱长分别为a cm和b cm,则A、B两种晶体的密度之比为___.
③图A的堆积方式空间利用率___(用含π的式子表示)
▼优质解答
答案和解析
X、Y、Z、M、W均为周期表中前四周期的元素,X的基态原子外围电子排布式为3s2,则X为第三周期ⅡA族元素,为Mg元素;
Y基态原子的L电子层的p能级上有一个空轨道,原子核外电子排布为1s22s22p2,则Y为C元素;
Z元素的基态原子最外层有3个未成对电子,次外层有2个电子,则Z处于第二周期,电子排布式为:1s22s22p3,为N元素;
M的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反,原子核外电子排布为1s22s22p4,则M为O元素;
W为过渡元素,它的其基态原子外围电子排布成对电子数是未成对电子数4倍,核外电子排布为1s22s22p63s23p63d54s2,故W为Mn元素,
(1)X为Mg元素,其基态原子核外电子排布为1s22s22p63s2,每一个电子的运动状态均不同,故核外有12种运动状态不同的电子,故答案为:12;
(2)ZM3-为NO3-,NO3-中N原子的价层电子对数为:
=3,没有孤电子对,所以NO3-的空间构型为平面三角形,N原子采用sp2杂质,
故答案为:平面三角形;sp2;
(3)W与YM易形成配合物W(YM)4为Mn(CO)4,Mn与CO易形成配合物Fe(CO)4化合价的代数和为0,CO的化合价的代数和为0,则Mn的化合价为0;
根据等电子体的定义,CO的等电子体必须是双原子分子或离子,且电子总数相等,所以与CO分子互为等电子体的离子的化学式为CN-或C22-,O22+,
故答案为:Mn;0;CN-或C22-,O22+;
(4)①以顶点Mn原子研究,与之最近的原子处于面心,每个顶点为12个面共用,故面心立方最密堆积中Mn原子配位数为12,体心立方堆积中Mn原子配位数为8,故A、B两种堆积中配位数之比为8:12=2:3,
故答案为:面心立方最密堆积;2:3;
②A中原子占据体心和顶点,为体心立方结构,原子数为1+8×
=2,B中占据顶点和面心,原子数为6×
+8×
=4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比1:2;A、B晶胞的棱长分别为a cm和b cm,体积分别为a3cm3、b3cm3,晶胞的密度等于晶胞中铁原子的质量与体积的比,为
:
=b3:2a3,
故答案为:b3:2a3;
③图A中原子数目为1+8×
=2,原子半径为r,原子总体积为2×
,晶胞体积为(
)3,空间利用率=
×100%=
×100%,
故答案为:
×100%.
Y基态原子的L电子层的p能级上有一个空轨道,原子核外电子排布为1s22s22p2,则Y为C元素;
Z元素的基态原子最外层有3个未成对电子,次外层有2个电子,则Z处于第二周期,电子排布式为:1s22s22p3,为N元素;
M的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反,原子核外电子排布为1s22s22p4,则M为O元素;
W为过渡元素,它的其基态原子外围电子排布成对电子数是未成对电子数4倍,核外电子排布为1s22s22p63s23p63d54s2,故W为Mn元素,
(1)X为Mg元素,其基态原子核外电子排布为1s22s22p63s2,每一个电子的运动状态均不同,故核外有12种运动状态不同的电子,故答案为:12;
(2)ZM3-为NO3-,NO3-中N原子的价层电子对数为:
| 5+1 |
| 2 |
故答案为:平面三角形;sp2;
(3)W与YM易形成配合物W(YM)4为Mn(CO)4,Mn与CO易形成配合物Fe(CO)4化合价的代数和为0,CO的化合价的代数和为0,则Mn的化合价为0;
根据等电子体的定义,CO的等电子体必须是双原子分子或离子,且电子总数相等,所以与CO分子互为等电子体的离子的化学式为CN-或C22-,O22+,
故答案为:Mn;0;CN-或C22-,O22+;
(4)①以顶点Mn原子研究,与之最近的原子处于面心,每个顶点为12个面共用,故面心立方最密堆积中Mn原子配位数为12,体心立方堆积中Mn原子配位数为8,故A、B两种堆积中配位数之比为8:12=2:3,
故答案为:面心立方最密堆积;2:3;
②A中原子占据体心和顶点,为体心立方结构,原子数为1+8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 2m |
| a3 |
| 4m |
| b3 |
故答案为:b3:2a3;
③图A中原子数目为1+8×
| 1 |
| 8 |
| 4πr3 |
| 3 |
| 4r | ||
|
| 原子总体积 |
| 晶胞体积 |
| ||
| 8 |
故答案为:
| ||
| 8 |
看了 X、Y、Z、M、R、W均为周...的网友还看了以下:
若有以下定义,则值为4的表达式是 A)p+=3,*(p++) B)p+=3,*++p C)p+=4 2020-05-13 …
线性变换....已知P^3的线性变换A(a,b,c)=(2b+c,a-4b,3a)求A在基α1=( 2020-05-21 …
三相功率P=根号3*U*I*COSφ=660*U*I*COSφ,单相p=U*I*COSφ=220* 2020-07-19 …
关于未来下雨的概率的求法已知未来3天每天下雨概率都为70%,求未来3天有2天下雨的概率已知未来3天 2020-07-30 …
指针问题设intx[]={1,2,3,4,5,6},*p=x;则数值为3的表达式是(B)。(A)p 2020-07-30 …
在p^4中,求由基ξ1,ξ2,ξ3,ξ4到基η1,η2,η3,η4的过渡矩阵,并求向量α在所指基底下 2020-11-02 …
已知玉米胚乳有色至少受3对基因控制,一是基本色泽基因C/c,一是紫色基因P/p,P表现紫色,p表现红 2020-11-24 …
真正的数学难题已知M,N,P为常数,a,b,c为未知数,求解方程组:ab+c=M(1)bc+a=N( 2020-11-27 …
小白鼠体细胞内的6号染色体上有P基因和Q基因,它们编码各自蛋白质的前3个氨基酸的DNA序列如图,起始 2020-12-05 …
用逻辑联结词“且”、“或”联结命题p,q,并判断复合命题“p且q”、“p或q”的真假:1、p:6是3 2020-12-07 …