早教吧作业答案频道 -->化学-->
合成氨工业是基础化学工业的重要组成部分.(1)以NH3与CO2为原料可合成化肥尿素.已知:①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ•mol-1②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(l)△H=+28.5kJ
题目详情
合成氨工业是基础化学工业的重要组成部分.
(1)以NH3与CO2为原料可合成化肥尿素.
已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(l)△H=+28.5kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则NH3(g)与CO2(g)合成CO(NH2)2(s)和H2O(g)的热化学方程式为___.
(2)工业合成氨在合成塔中进行,测得合成塔入口气体体积比N2:H2:NH3为6:18:1,出口气体体积比N2:H2:NH3为9:27:8,则H2的转化率为___.
(3)为降低合成氨工业废水的氨氮浓度,在厌氧氨氧化菌的催化作用下,使铵盐与亚硝酸盐反应生成N2,该反应的离子方程式是___.
(4)犹他大学化学家发明了N2/H2生物燃料电池,以质子交换膜为隔膜,室温条件下合成了氨的同时还提供了电能(工作原理如图1所示).该生物燃料电池中,正极电极反应式为___.
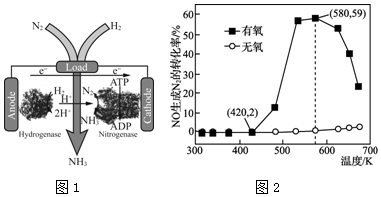
(5)NH3可用于烟气的脱硝,使烟气中的NO还原为N2.某研究小组研究了NH3和NO在Ag2O催化剂表面的反应活性随温度的变化关系,实验结果如图2所示.在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是___.在温度为420~580K时,有氧条件下NO生成N2的转化率明显高于无氧条件的原因可能是___.
(1)以NH3与CO2为原料可合成化肥尿素.
已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(l)△H=+28.5kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则NH3(g)与CO2(g)合成CO(NH2)2(s)和H2O(g)的热化学方程式为___.
(2)工业合成氨在合成塔中进行,测得合成塔入口气体体积比N2:H2:NH3为6:18:1,出口气体体积比N2:H2:NH3为9:27:8,则H2的转化率为___.
(3)为降低合成氨工业废水的氨氮浓度,在厌氧氨氧化菌的催化作用下,使铵盐与亚硝酸盐反应生成N2,该反应的离子方程式是___.
(4)犹他大学化学家发明了N2/H2生物燃料电池,以质子交换膜为隔膜,室温条件下合成了氨的同时还提供了电能(工作原理如图1所示).该生物燃料电池中,正极电极反应式为___.

(5)NH3可用于烟气的脱硝,使烟气中的NO还原为N2.某研究小组研究了NH3和NO在Ag2O催化剂表面的反应活性随温度的变化关系,实验结果如图2所示.在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是___.在温度为420~580K时,有氧条件下NO生成N2的转化率明显高于无氧条件的原因可能是___.
▼优质解答
答案和解析
(1)①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(l)△H=+28.5kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
盖斯定律计算①+②+③,则NH3(g)与CO2(g)合成CO(NH2)2(s)和H2O(g)的热化学方程式为2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)△H=-87 kJ•mol-1 ,
故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)△H=-87 kJ•mol-1;
(2)合成氨反应为:N2+3H2⇌2NH3,测得合成塔入口处气体N2、H2、NH3的体积比为6:18:1,设这三种气体体积分别为6xL、18xL、xL,设H2的转化率为a,则参加反应的氢气体积为18xaL,出口处N2、H2、NH3的体积分别为6x(1-a)L、(18x-18xa)L、(x+12xa)L,出口处N2、H2、NH3的体积比为9:27:8,即6x(1-a)L:(18x-18xa)L:(x+12xa)L=9:27:8,则氢气转化率a为25%,
故答案为:25%;
(3)在厌氧氨氧化菌的催化作用下,使铵盐与亚硝酸盐反应生成N2和水,反应的离子方程式为:NH4++NO2-
N2+2H2O,
故答案为:NH4++NO2-
N2+2H2O;
(4)N2/H2生物燃料电池,以质子交换膜为隔膜,室温条件下合成了氨的同时还提供了电能,是发生原电池反应,负极是氢气失电子发生氧化反应,正极是氮气得到电子发生还原反应,正极电极反应N2+6e-+6H+═2NH3,
故答案为:N2+6e-+6H+═2NH3;
(5)在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是催化剂活性降低,在温度为420~580K时,有氧条件下NO生成N2的转化率明显高于无氧条件的原因可能是:NO与O2反应生成NO2,NO2更易与NH3反应,
故答案为:催化剂活性降低;NO与O2反应生成NO2,NO2更易与NH3反应.
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(l)△H=+28.5kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
盖斯定律计算①+②+③,则NH3(g)与CO2(g)合成CO(NH2)2(s)和H2O(g)的热化学方程式为2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)△H=-87 kJ•mol-1 ,
故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)△H=-87 kJ•mol-1;
(2)合成氨反应为:N2+3H2⇌2NH3,测得合成塔入口处气体N2、H2、NH3的体积比为6:18:1,设这三种气体体积分别为6xL、18xL、xL,设H2的转化率为a,则参加反应的氢气体积为18xaL,出口处N2、H2、NH3的体积分别为6x(1-a)L、(18x-18xa)L、(x+12xa)L,出口处N2、H2、NH3的体积比为9:27:8,即6x(1-a)L:(18x-18xa)L:(x+12xa)L=9:27:8,则氢气转化率a为25%,
故答案为:25%;
(3)在厌氧氨氧化菌的催化作用下,使铵盐与亚硝酸盐反应生成N2和水,反应的离子方程式为:NH4++NO2-
| ||
故答案为:NH4++NO2-
| ||
(4)N2/H2生物燃料电池,以质子交换膜为隔膜,室温条件下合成了氨的同时还提供了电能,是发生原电池反应,负极是氢气失电子发生氧化反应,正极是氮气得到电子发生还原反应,正极电极反应N2+6e-+6H+═2NH3,
故答案为:N2+6e-+6H+═2NH3;
(5)在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是催化剂活性降低,在温度为420~580K时,有氧条件下NO生成N2的转化率明显高于无氧条件的原因可能是:NO与O2反应生成NO2,NO2更易与NH3反应,
故答案为:催化剂活性降低;NO与O2反应生成NO2,NO2更易与NH3反应.
看了 合成氨工业是基础化学工业的重...的网友还看了以下:
对以下化合物叙述正确的是()①该化合物有3个肽键,由4个氨基酸失去4个水分子形成的化合物,称为四肽 2020-05-13 …
对以下化合物叙述正确的是()①该化合物分子中有4个肽键,脱去5个水分子,形成的化合物是5肽②该化合 2020-05-13 …
如图是某化合物的结构示意图,请据图判断下列叙述中不正确的()A.③⑤⑦都是肽键B.该化合物由4个氨 2020-05-13 …
下列说法正确的是()A.羟基跟链烃基直接相连的化合物属于醇类B.含有羟基的化合物属于醇类C.酚类和 2020-06-26 …
有机化学推断题··求答案··十万火急某未知化合物,分子式为C4H8O,能发生银镜反应.A与乙基溴化 2020-07-05 …
有机化学结构推测化合物A(C5H12O)有旋光性.它在碱性KMnO4溶液作用下生成B(C5H10O 2020-07-09 …
下列说法正确的是()A、分子中含有碳碳双键的有机化合物一定是烯烃B、有机化合物中一定含有氢原子C、含 2020-11-01 …
下列是三种化合物的结构简式,有关三种化合物的叙述中错误的是()A.三种化合物可以用一个结构通式表示B 2020-12-05 …
如图是三种化合物的结构式,下列有关三种化合物的叙述中,错误的是()A.三种化合物可以用一个结构通式表 2020-12-21 …
将劳氏肉瘤病毒遗传物质的一个基本单位彻底水解后得到A、B、C三种化合物,将T2噬菌体遗传物质的一个基 2020-12-28 …