早教吧作业答案频道 -->化学-->
氨是一种重要的化工产品.(1)热化学循环制氢可以采用如下的反应:①Br2(g)+CaO(s)=CaBr2(s)+12O2(g)△H=-73kJ•mol-1②CaBr2(s)+H2O(g)=CaO(s)+2HBr(g)△H=+212kJ
题目详情
氨是一种重要的化工产品.
(1)热化学循环制氢可以采用如下的反应:
①Br2(g)+CaO(s)=CaBr2(s)+
O2(g)△H=-73kJ•mol-1
②CaBr2(s)+H2O(g)=CaO(s)+2HBr(g)△H=+212kJ•mol-1
③Fe3O4(s)+8HBr(g)=Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ•mol-1
④3FeBr2(s)+4H2O(g)=Fe3O4(s)+6HBr(g)+H2(g)△H=+354kJ•mol-1
则H2O(g)H2(g)+
O2(g)△H=___kJ•mol-1.
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ•mol-1.可判定该可逆反应达到平衡状态标志的选项是___.
A.v(N2)正=2v(NH3)逆
B.单位时间生成amolN2的同时消耗3amolH2
C.混合气体的密度不再随时间变化
D.容器内的总压强不再随时间而变化
E.amolN≡N键断裂的同时,有6amolN-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
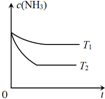
(3)反应2NH3(g)N2(g)+3H2(g)在容积为1.0L的密闭容器中进行,NH3的初始浓度为0.05mol/L.温度T1和T2下NH3的浓度与时间关系如图所示.回答下列问题:
①上述反应的温度T1___T2,平衡常数K(T1)___K(T2).(填“大于”、“小于”或“等于”)
②若温度T2时,5min后反应达到平衡,NH3的转化率为80%,则:平衡时混合气体总的物质的量为___.反应在0~5min区间的平均反应速率v(N2)=___.
(4)某化学小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
则反应在该温度下平衡常数K=___(保留三三位有效数字);保持温度不变,30min时再向该密闭容器中投入0.5molN2、0.5molH2和1molNH3,此时反应将___(填“正向进行”、“逆向进行”或“处于平衡状态”).
(5)以氨为燃料可以设计制造氨燃料电池,产物无污染.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为___.

(1)热化学循环制氢可以采用如下的反应:
①Br2(g)+CaO(s)=CaBr2(s)+
| 1 |
| 2 |
②CaBr2(s)+H2O(g)=CaO(s)+2HBr(g)△H=+212kJ•mol-1
③Fe3O4(s)+8HBr(g)=Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ•mol-1
④3FeBr2(s)+4H2O(g)=Fe3O4(s)+6HBr(g)+H2(g)△H=+354kJ•mol-1
则H2O(g)H2(g)+
| 1 |
| 2 |
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ•mol-1.可判定该可逆反应达到平衡状态标志的选项是___.
A.v(N2)正=2v(NH3)逆
B.单位时间生成amolN2的同时消耗3amolH2
C.混合气体的密度不再随时间变化
D.容器内的总压强不再随时间而变化
E.amolN≡N键断裂的同时,有6amolN-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
(3)反应2NH3(g)N2(g)+3H2(g)在容积为1.0L的密闭容器中进行,NH3的初始浓度为0.05mol/L.温度T1和T2下NH3的浓度与时间关系如图所示.回答下列问题:
①上述反应的温度T1___T2,平衡常数K(T1)___K(T2).(填“大于”、“小于”或“等于”)
②若温度T2时,5min后反应达到平衡,NH3的转化率为80%,则:平衡时混合气体总的物质的量为___.反应在0~5min区间的平均反应速率v(N2)=___.
(4)某化学小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
(5)以氨为燃料可以设计制造氨燃料电池,产物无污染.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为___.
▼优质解答
答案和解析
(1)因为①Br2(g)+CaO(s)=CaBr2(s)+12O2(g)△H=-73kJ•mol-1
②CaBr2(s)+H2O(g)=CaO(s)+2HBr(g)△H=+212kJ•mol-1
③Fe3O4(s)+8HBr(g)=Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ•mol-1
④3FeBr2(s)+4H2O(g)=Fe3O4(s)+6HBr(g)+H2(g)△H=+354kJ•mol-1
则由盖斯定律①+②+③+④得到:H2O(g)⇌H2(g)+1/2O2(g)△H=+249KJ/mol,
故答案为:+249;
(2)根据反应N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1,
A.速率之比与化学计量数成正比,2v(N2)正=v(NH3)逆,故A错误;
B.单位时间生成amolN2的同时消耗3amolH2,方向相反成正比例,故B正确;
C.混合气体的密度=m/V,混合气体的质量不变更,V反应前后不变,故密度不是变量,不能判断平衡,故C错误;
D.容器内的总压强为变量,故压强不再随时间而变化则平衡,故D正确;
E.amolN≡N键断裂的同时,有6amolN-H键断裂,方向相反成正比例,能作为平衡的标志,故E正确;
F.N2、H2、NH3的分子数之比为1:3:2任何时候均成立,故F错误,
故选:BDE;
(3)①由图可知T2先达平衡状态,所以T1小于T2,而温度越高K越小,所以正反应为吸热反应,所以温度越高K值越大,故答案为:小于;小于;
②2NH3(g)⇌N2(g)+3H2(g)
起始浓度:0.050 0 0
变化浓度:0.04 0.02 0.06
平衡浓度:0.01 0.02 0.06
平衡时体系总的物质的量为=(0.01+0.02+0.06)×1=0.09mol;
反应在0~5min区间的平均反应速率v(N2)=0.025=0.004mol/(L•min);
故答案为:0.09mol;0.004mol/(L•min);
(4)一温度下,容器中气体压强与总的物质的量成正比,设平衡状态时混合气体的物质的量为x,
16.80:12.60=(1+3)mol:x,x=4mol×12.6016.80=3mol,所以平衡时混合气体的物质的量为3mol,
设参加反应的氮气的物质的量为y,
N2(g)+3H2(g)⇌2NH3(g)物质的量减少
1mol 2mol
y (4-3)mol
1mol:2mol=y:(4-3)mol,
y=1mol×(4-3)mol2mol=0.5mol,
平衡时,c(N2)═0.25mol/L、c(H2)=3mol-3×0.5mol2L=0.75mol/L、c(NH3)=0.5mol/L,化学平衡常数K=0.5×0.50.25×(0.75)3( mol/L)-2=2.37( mol/L)-2,
Qc=10.5×0.53故答案为:2.37( mol/L)-2;正向进行;
(5)碱性燃料电池中,负极上燃烧失电子发生氧化反应,所以该原电池中负极上氨气失电子和氢氧根离子反应生成氮气和水,电极反应式为2NH3-6e-+6OH-=N2+6H2O,故答案为:2NH3-6e-+6OH-=N2+6H2O.
②CaBr2(s)+H2O(g)=CaO(s)+2HBr(g)△H=+212kJ•mol-1
③Fe3O4(s)+8HBr(g)=Br2(g)+3FeBr2(s)+4H2O(g)△H=-274kJ•mol-1
④3FeBr2(s)+4H2O(g)=Fe3O4(s)+6HBr(g)+H2(g)△H=+354kJ•mol-1
则由盖斯定律①+②+③+④得到:H2O(g)⇌H2(g)+1/2O2(g)△H=+249KJ/mol,
故答案为:+249;
(2)根据反应N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1,
A.速率之比与化学计量数成正比,2v(N2)正=v(NH3)逆,故A错误;
B.单位时间生成amolN2的同时消耗3amolH2,方向相反成正比例,故B正确;
C.混合气体的密度=m/V,混合气体的质量不变更,V反应前后不变,故密度不是变量,不能判断平衡,故C错误;
D.容器内的总压强为变量,故压强不再随时间而变化则平衡,故D正确;
E.amolN≡N键断裂的同时,有6amolN-H键断裂,方向相反成正比例,能作为平衡的标志,故E正确;
F.N2、H2、NH3的分子数之比为1:3:2任何时候均成立,故F错误,
故选:BDE;
(3)①由图可知T2先达平衡状态,所以T1小于T2,而温度越高K越小,所以正反应为吸热反应,所以温度越高K值越大,故答案为:小于;小于;
②2NH3(g)⇌N2(g)+3H2(g)
起始浓度:0.050 0 0
变化浓度:0.04 0.02 0.06
平衡浓度:0.01 0.02 0.06
平衡时体系总的物质的量为=(0.01+0.02+0.06)×1=0.09mol;
反应在0~5min区间的平均反应速率v(N2)=0.025=0.004mol/(L•min);
故答案为:0.09mol;0.004mol/(L•min);
(4)一温度下,容器中气体压强与总的物质的量成正比,设平衡状态时混合气体的物质的量为x,
16.80:12.60=(1+3)mol:x,x=4mol×12.6016.80=3mol,所以平衡时混合气体的物质的量为3mol,
设参加反应的氮气的物质的量为y,
N2(g)+3H2(g)⇌2NH3(g)物质的量减少
1mol 2mol
y (4-3)mol
1mol:2mol=y:(4-3)mol,
y=1mol×(4-3)mol2mol=0.5mol,
平衡时,c(N2)═0.25mol/L、c(H2)=3mol-3×0.5mol2L=0.75mol/L、c(NH3)=0.5mol/L,化学平衡常数K=0.5×0.50.25×(0.75)3( mol/L)-2=2.37( mol/L)-2,
Qc=10.5×0.53
(5)碱性燃料电池中,负极上燃烧失电子发生氧化反应,所以该原电池中负极上氨气失电子和氢氧根离子反应生成氮气和水,电极反应式为2NH3-6e-+6OH-=N2+6H2O,故答案为:2NH3-6e-+6OH-=N2+6H2O.
看了 氨是一种重要的化工产品.(1...的网友还看了以下:
物体A的质量为10千克,放在水平地面上,物体A与地面的动摩擦因数为0.2,如果用与水平面成30º的 2020-04-09 …
当把肯定句改为疑问句时,动词需要变吗?比如第三人称动词一般加"s",如果改为疑问句,还要不要"s" 2020-05-13 …
某奶粉生产厂要制造一种容积为2升(1升=1立方分米)的圆柱形桶,桶的底面面积s与桶高h有怎样的函数 2020-05-14 …
英语中动词何时+s我知道第三人称单数+s,但是除了这个,还有什么要+s?第一人称,第二人称的单复数 2020-07-19 …
V是什么单位C是什么单位根据1N/C=1V/mN=kg*m/s^2那么V=kg*m^2/(s^2*C 2020-11-01 …
(1)一个力可以使质量为3kg的物体产生4m/s^2的加速度,同样可以使质量为4kg的物体产生加速度 2020-11-01 …
一块铁块在6N的力产生加速度是2m/S²求铁块质量要产生3m/S²的加速度求施加力大小 2020-11-21 …
关于牛顿第二定律的问题求解释!牛顿第二定律中对1N的定义:“使质量为1kg的物体产生1m/s^2(s 2021-02-04 …
在厘米•克•秒制中,使质量是1g的物体产生1cm/s²加速度的力叫1dyn在厘米•克•秒制中,力的单 2021-02-04 …
一物体在5N的外力作用下,产生1dm/s²的加速度,求该物体的质量,其中单位运用正确的是A:m=F/ 2021-02-04 …