早教吧作业答案频道 -->化学-->
(Ⅰ)部分弱酸的电离平衡常数如表:弱酸HCOOHHClOH2CO3H2SO3电离平衡常数(25℃)Ka=1.77×10-4Ka=4.0×10-8Ka1=4.3×10-7Ka2=4.7×10-11Ka1=1.54×10-2Ka2=1.02×10
题目详情
(Ⅰ)部分弱酸的电离平衡常数如表:
(1)室温下①0.1mol•L-1 HCOONa,②0.1mol•L-1 NaClO,③0.1mol•L-1 Na2CO3,④0.1mol•L-1 NaHCO3溶液的pH由大到小的关系为___.
(2)浓度均为0.1mol•L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为___.
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式___.
(4)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为___.
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液.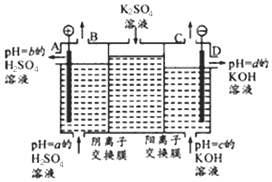
①该电解槽中通过阴离子交换膜的离子数___(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为___;
③电解一段时间后,B出口与C出口产生气体的质量比为___.
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(2)浓度均为0.1mol•L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为___.
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式___.
(4)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为___.
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液.

①该电解槽中通过阴离子交换膜的离子数___(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为___;
③电解一段时间后,B出口与C出口产生气体的质量比为___.
▼优质解答
答案和解析
(Ⅰ)(1)图表中比较得到酸性强弱H2SO3>HCOOH>HSO3->H2CO3>HClO>HCO3-,对应盐水解程度HSO3--32-3--32-,室温下①0.1mol•L-1 HCOONa,②0.1mol•L-1 NaClO,③0.1mol•L-1 Na2CO3,④0.1mol•L-1 NaHCO3溶液的pH由大到小的关系为:③②④①,
故答案为:③②④①;
(2)水解程度越大,溶液中酸根离子浓度越小,水解程度:CO32->SO32-,则溶液中离子浓度:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-),
故答案为:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-);
(3)根据强酸制取弱酸知,H2SO3>HCOOH>HSO3->H2CO3>HClO>HCO3-,少量CO2通入到过量的NaClO溶液中生成次氯酸和碳酸氢钠,离子方程式为:ClO-+CO2+H2O=HCO3-+HClO,故答案为:ClO-+CO2+H2O=HCO3-+HClO;
(4)甲酸为弱电解质,pH=3的甲酸和pH=11的氢氧化钠溶液等体积混合,甲酸过量,溶液呈酸性,则c(H+)>c(OH-),溶液中存在:c(HCOO-)+c(OH-)=c(Na+)+c(H+),则c(Na+)-),离子浓度顺序是:c(HCOO-)>c(Na+)>c(H+)>c(OH-).
故答案为:c(HCOO-)>c(Na+)>c(H+)>c(OH-);
(Ⅱ)①电解硫酸钾溶液,阳极发生氧化反应,OH-被氧化生成O2,SO42-通过阴离子交换膜向阳极移动,钾离子通过阳离子交换膜向阴极移动,由电荷守恒知钾离子数目大于硫酸根离子数目,
故答案为:<;
②阳极上阴离子OH-被氧化,pH减小,阴极阳离子氢离子发生还原反应生成H2和OH-,pH增大,则pH为b③B口生成氧气,C生成氢气,物质的量之比为1:2,则质量之比为32:4=8:1,
故答案为:8:1.
故答案为:③②④①;
(2)水解程度越大,溶液中酸根离子浓度越小,水解程度:CO32->SO32-,则溶液中离子浓度:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-),
故答案为:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-);
(3)根据强酸制取弱酸知,H2SO3>HCOOH>HSO3->H2CO3>HClO>HCO3-,少量CO2通入到过量的NaClO溶液中生成次氯酸和碳酸氢钠,离子方程式为:ClO-+CO2+H2O=HCO3-+HClO,故答案为:ClO-+CO2+H2O=HCO3-+HClO;
(4)甲酸为弱电解质,pH=3的甲酸和pH=11的氢氧化钠溶液等体积混合,甲酸过量,溶液呈酸性,则c(H+)>c(OH-),溶液中存在:c(HCOO-)+c(OH-)=c(Na+)+c(H+),则c(Na+)
故答案为:c(HCOO-)>c(Na+)>c(H+)>c(OH-);
(Ⅱ)①电解硫酸钾溶液,阳极发生氧化反应,OH-被氧化生成O2,SO42-通过阴离子交换膜向阳极移动,钾离子通过阳离子交换膜向阴极移动,由电荷守恒知钾离子数目大于硫酸根离子数目,
故答案为:<;
②阳极上阴离子OH-被氧化,pH减小,阴极阳离子氢离子发生还原反应生成H2和OH-,pH增大,则pH为b
故答案为:8:1.
看了 (Ⅰ)部分弱酸的电离平衡常数...的网友还看了以下:
口算2.4+0.73=3.08×4=537-99=2.6×0.3=3-0.71-0.19=8-0. 2020-04-07 …
请帮我算下这个数独的答案,{4,2,0,0,9,0,0,0,0}{5,0,7,3,0,0,0,0, 2020-04-26 …
观察数列:...由此递推数列的第100项是?为什么选A呢?观察数列:7,7,7+7,7,7+7,7 2020-04-27 …
数学门诊.(把不对的改正过来)(1)1.7×0.31+0.69×1.7=1.7×(0.31+0.6 2020-06-22 …
计算:(1)299.9×19.98-199.8×29.97;(2)3.14+64.8×0.537× 2020-07-09 …
一、口算:0.1×208=7.2÷36=4.8÷16=1.3×50=0.5×20=0.81÷0.0 2020-07-19 …
下列式子排列正确的是()A.0.•7•7>0.•7>0.77>0.7B.0.77>0.•7>0.•7 2020-11-01 …
直接写出得数6.9-6=0.9+0.6=1-0.09=0.9+0.1=2.7+2.2=0.2+0.8 2020-11-04 …
无限循环小数化分数..设0.7=X,有0.7=0.777…可在,10X-X=7.777……-0.77 2021-01-22 …
无限循环小数化分数。。设0.7=X,有0.7=0.777…可在,10X-X=7.777……-0.77 2021-01-22 …