早教吧作业答案频道 -->化学-->
KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等.(1)在K2MnO4溶液中通入CO2可制得高锰酸钾,副产物是黑色沉淀M.该反应中氧化剂与还原剂的质量之比为.由锂离子有机高聚物
题目详情
KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等.
(1)在K2MnO4溶液中通入CO2可制得高锰酸钾,副产物是黑色沉淀M.该反应中氧化剂与还原剂的质量之比为___.由锂离子有机高聚物、锂及M构成原电池,电池反应为Li+M=LiM(s),消耗8.7gM时转移0.1mol电子.则该电池正极的电极反应为___.
(2)实验室用KMnO4制备O2和Cl2.取0.4mol KMnO4固体加热一段时间后,收集到amolO2,在反应后的残留固体中加入足量浓盐酸,加热又收集到bmolCl2.设锰元素全部转化成Mn2+存在于溶液中,当a+b=0.8mol时,在标准状况下生成Cl2的体积为___L;
(3)电解K2MnO4溶液加以制备KMnO4.工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为___.用镍片作阳极(镍不参与反应),铁板为阴极,电解K2MnO4溶液可制备KMnO4.上述过程用流程图表示如下:
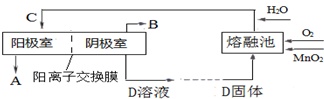
则D的化学式为___;阳极的电极反应式为___;阳离子迁移方向是___.
(4)高锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体.实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为SO42-).过二硫酸可以看成是H2O2的衍生物,过二硫酸铵中含有过氧键(-O-O-).写出检验Mn2+的离子方程式___.如果将这个反应设计成盐桥原电池,盐桥中溶液最好选用___.(选填:饱和KCl溶液、饱和K2SO4溶液或饱和NH4Cl溶液)4
242
4224222+2
244224244

2+2+42282+42-222+244
(1)在K2MnO4溶液中通入CO2可制得高锰酸钾,副产物是黑色沉淀M.该反应中氧化剂与还原剂的质量之比为___.由锂离子有机高聚物、锂及M构成原电池,电池反应为Li+M=LiM(s),消耗8.7gM时转移0.1mol电子.则该电池正极的电极反应为___.
(2)实验室用KMnO4制备O2和Cl2.取0.4mol KMnO4固体加热一段时间后,收集到amolO2,在反应后的残留固体中加入足量浓盐酸,加热又收集到bmolCl2.设锰元素全部转化成Mn2+存在于溶液中,当a+b=0.8mol时,在标准状况下生成Cl2的体积为___L;
(3)电解K2MnO4溶液加以制备KMnO4.工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为___.用镍片作阳极(镍不参与反应),铁板为阴极,电解K2MnO4溶液可制备KMnO4.上述过程用流程图表示如下:

则D的化学式为___;阳极的电极反应式为___;阳离子迁移方向是___.
(4)高锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体.实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为SO42-).过二硫酸可以看成是H2O2的衍生物,过二硫酸铵中含有过氧键(-O-O-).写出检验Mn2+的离子方程式___.如果将这个反应设计成盐桥原电池,盐桥中溶液最好选用___.(选填:饱和KCl溶液、饱和K2SO4溶液或饱和NH4Cl溶液)4
242
4224222+2
244224244

2+2+42282+42-222+244
▼优质解答
答案和解析
(1)反应物为K22MnO44、CO22、生成黑色固体MnO22、KMnO44,所以的化学方程式为:3K22MnO44+2CO22═2KMnO44+MnO22+2K22CO33;由化学反应方程式:3K22MnO44+2CO22═2KMnO44+MnO22+2K22CO33分析得出,3molK22MnO44参加反应生成2molKMnO44、1molMnO22,即3mol高锰酸钾参与反应有1mol作氧化剂、2mol作还原剂,则反应中氧化剂与还原剂的质量比为1:2;锂离子有机高聚物、锂及MnO22构成原电池,正极上发生得电子的还原反应,电极反应式为:MnO22+e--+Li++=LiMnO22,
故答案为:1:2;MnO22+e--+Li++=LiMnO22;
(2)KMnO44固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体b mol氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.4×(7-2)=4a+2b=2mol,a+b=0.8mol,解得a=0.2,b=0.6,在标准状况下生成Cl22的体积为0.6mol×22.4L/mol=13.44L,故答案为:13.44;
(3)根据信息:软锰矿(主要成分是MnO22)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K22MnO44来书写方程式为:2MnO22+4KOH+O22
2K2MnO4+2H2O;电解锰酸钾溶液时阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-═H2↑+2OH-,iD是氢氧化钾溶液,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-═2MnO4-,K+由阳离子交换膜左侧向右侧迁移,
故答案为:2MnO2+4KOH+O2
2K2MnO4+2H2O;KOH;MnO42--e-=MnO4-;K+由阳离子交换膜左侧向右侧迁移;
(4)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵)溶液会发生氧化还原反应2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+,(NH4)2S2O8(连二硫酸铵)溶液具有强氧化性,选择的盐桥中溶液不能被其氧化,可以选择:饱和K2SO4溶液.
故答案为:2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+;饱和K2SO4溶液.
△ △ △ △ 2K22MnO44+2H22O;电解锰酸钾溶液时阴极上水得电子生成氢气和氢氧根离子,电极反应为2H22O+2e--═H22↑+2OH--,iD是氢氧化钾溶液,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO442-2--2e--═2MnO44--,K++由阳离子交换膜左侧向右侧迁移,
故答案为:2MnO22+4KOH+O22
2K2MnO4+2H2O;KOH;MnO42--e-=MnO4-;K+由阳离子交换膜左侧向右侧迁移;
(4)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵)溶液会发生氧化还原反应2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+,(NH4)2S2O8(连二硫酸铵)溶液具有强氧化性,选择的盐桥中溶液不能被其氧化,可以选择:饱和K2SO4溶液.
故答案为:2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+;饱和K2SO4溶液.
△ △ △ △ 2K22MnO44+2H22O;KOH;MnO442-2--e--=MnO44--;K++由阳离子交换膜左侧向右侧迁移;
(4)在酸性介质中,往MnSO44溶液里滴加(NH44)22S22O88(连二硫酸铵)溶液会发生氧化还原反应2Mn2+2++5S22O882-2-+8H22O=2MnO44--+10SO442-2-+16H++,(NH44)22S22O88(连二硫酸铵)溶液具有强氧化性,选择的盐桥中溶液不能被其氧化,可以选择:饱和K22SO44溶液.
故答案为:2Mn2+2++5S22O882-2-+8H22O=2MnO44--+10SO442-2-+16H++;饱和K22SO44溶液.
故答案为:1:2;MnO22+e--+Li++=LiMnO22;
(2)KMnO44固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体b mol氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.4×(7-2)=4a+2b=2mol,a+b=0.8mol,解得a=0.2,b=0.6,在标准状况下生成Cl22的体积为0.6mol×22.4L/mol=13.44L,故答案为:13.44;
(3)根据信息:软锰矿(主要成分是MnO22)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K22MnO44来书写方程式为:2MnO22+4KOH+O22
| ||
故答案为:2MnO2+4KOH+O2
| ||
(4)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵)溶液会发生氧化还原反应2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+,(NH4)2S2O8(连二硫酸铵)溶液具有强氧化性,选择的盐桥中溶液不能被其氧化,可以选择:饱和K2SO4溶液.
故答案为:2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+;饱和K2SO4溶液.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.故答案为:2MnO22+4KOH+O22
| ||
(4)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵)溶液会发生氧化还原反应2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+,(NH4)2S2O8(连二硫酸铵)溶液具有强氧化性,选择的盐桥中溶液不能被其氧化,可以选择:饱和K2SO4溶液.
故答案为:2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+;饱和K2SO4溶液.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.(4)在酸性介质中,往MnSO44溶液里滴加(NH44)22S22O88(连二硫酸铵)溶液会发生氧化还原反应2Mn2+2++5S22O882-2-+8H22O=2MnO44--+10SO442-2-+16H++,(NH44)22S22O88(连二硫酸铵)溶液具有强氧化性,选择的盐桥中溶液不能被其氧化,可以选择:饱和K22SO44溶液.
故答案为:2Mn2+2++5S22O882-2-+8H22O=2MnO44--+10SO442-2-+16H++;饱和K22SO44溶液.
看了 KMnO4常用作氧化剂、防腐...的网友还看了以下:
请问这里的usually是频率副词做状语修饰动词go吗?Iusuallygotoworkat8.1 2020-05-13 …
及物动词加副词构成短语吗?我记得有不及物动词加介词,还有一种情况是加副词构成短语,那么是不及物加副 2020-05-13 …
treat me 后跟副词还是形容词?1 treat me 可以 跟副词还是形容词?2 treat 2020-05-13 …
英语感叹句!分不清how、what怎么用我知道how修饰形容词或副词what修饰名词但是我分不清句 2020-05-14 …
She must be at least forty.请问其中的at least是副词,还是介词短 2020-05-16 …
all这里是不是副词,语法达人指点all可以做副词,不定代词,形容词.Weareallstuden 2020-06-03 …
请问“不要”是动词还是副词?在这样一句话里——“不要断章取义”“不要”是一个副词,还是“不”为副词 2020-06-13 …
什么是副反应,是指一个反应过程中伴随的反应而最终副反应生成物又会被反应掉而最终不存在,还是说伴随主 2020-06-25 …
quick是形容词,quickly是副词,还有那些这样的单词,最好举5个.这样的形容词变副词的词形 2020-06-30 …
英语中到底是形容词修饰副词,还是副词修饰形容词?还是都可以?语法书中说,副词是可以修饰动词、形容词、 2021-02-03 …