早教吧作业答案频道 -->化学-->
五氯化磷(PCl5)是有机合成中重要的氯化剂,可以有三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g)⇌PCl5(g)△H=-93.0kJ•mol-1.某温度下,在容积恒定为2.0L的密闭容器中充入2.0molPCl3和1.0molCl2
题目详情
五氯化磷(PCl5)是有机合成中重要的氯化剂,可以有三氯化磷(PCl3)氯化得到:
PCl3(g)+Cl2(g)⇌PCl5(g)△H=-93.0kJ•mol-1.某温度下,在容积恒定为2.0L的密闭容器中充入2.0molPCl3和1.0molCl2,一段时间后反应达平衡状态,实验数据如表所示:
(1)0~150s内的平均反应速率v(PCl3)=___mol.L-1•s-1
(2)该温度下,此反应的化学平衡常数的数值为___(可用分数表示).
(3)反应至250s 时,该反应放出的热量为___kJ.
(4)下列关于上述反应的说法中,正确的是___(填字母序号).
a. 无论是否达平衡状态,混合气体的密度始终不变
b. 300s 时,升高温度,正、逆反应速率同时增大
c. 350s 时,向该密闭容器中充入氮气,平衡向正反应方向移动
d. 相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.2molCl2,达到化学平衡状态时,n(PCl5)<0.20mol
(5)温度T 1时,混合气体中PCl5的体积分数随时间t 变化的示意图如下.其他条件相同,请在下图中画出温度为T 2(T 2>T 1)时,PCl5的体积分数随时间变化的曲线.
PCl3(g)+Cl2(g)⇌PCl5(g)△H=-93.0kJ•mol-1.某温度下,在容积恒定为2.0L的密闭容器中充入2.0molPCl3和1.0molCl2,一段时间后反应达平衡状态,实验数据如表所示:

| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(2)该温度下,此反应的化学平衡常数的数值为___(可用分数表示).
(3)反应至250s 时,该反应放出的热量为___kJ.
(4)下列关于上述反应的说法中,正确的是___(填字母序号).
a. 无论是否达平衡状态,混合气体的密度始终不变
b. 300s 时,升高温度,正、逆反应速率同时增大
c. 350s 时,向该密闭容器中充入氮气,平衡向正反应方向移动
d. 相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.2molCl2,达到化学平衡状态时,n(PCl5)<0.20mol
(5)温度T 1时,混合气体中PCl5的体积分数随时间t 变化的示意图如下.其他条件相同,请在下图中画出温度为T 2(T 2>T 1)时,PCl5的体积分数随时间变化的曲线.
▼优质解答
答案和解析
(1)0~150s内的平均反应速率v(PCl5)=
=
mol.L-1•s-1=1.2×10-3或0.0012
mol.L-1•s-1,该段时间内v(PCl3)=v(PCl5)=1.2×10-3或0.0012mol.L-1•s-1,
故答案为:1.2×10-3或0.0012;
(2)开始时c(PCl3)=
=1.0mol/L、c(Cl2)=
=0.5mol/L,平衡时c(PCl5)=
=0.2mol/L,
PCl3(g)+Cl2(g)⇌PCl5(g)△H=-93.0kJ•mol-1,
开始(mol/L)1.0 0.5 0
反应(mol/L)0.2 0.2 0.2
平衡(mol/L)0.8 0.3 0.2
化学平衡常数K=
=
=
,
故答案为:
;
(3)生成1mol五氯化磷放出93.0kJ热量,250s时生成n(PCl5)=0.40mol放出热量=0.40mol×93.0kJ/mol=37.2kJ,故答案为:37.2;
(4)a.反应前后气体总质量不变、容器体积不变,根据ρ=
知,无论反应是否达到平衡状态密度始终不变,故a正确;
b.所有的化学反应只要升高温度正逆反应速率都增大,所以该反应升高温度正逆反应速率都增大,故b正确;
c.350s 时,向该密闭容器中充入氮气,参加反应的各气体分压不变、浓度不变,则化学平衡不移动,故c错误;
d.相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.2molCl2,与原反应相比,相当于减小压强平衡向气体体积增大的方向移动,则生成五氯化磷物质的量小于原来一半,故d正确;
故选abd;
(5)该反应的正反应是放热反应,升高温度化学反应速率加快,反应达到平衡时间缩短,但平衡逆向移动,达到平衡时五氯化磷体积分数降低,所以其图象为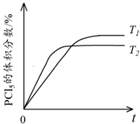 ,
,
故答案为: .
.
| ||
| △t |
| ||
| 150 |
mol.L-1•s-1,该段时间内v(PCl3)=v(PCl5)=1.2×10-3或0.0012mol.L-1•s-1,
故答案为:1.2×10-3或0.0012;
(2)开始时c(PCl3)=
| 2.0mol |
| 2.0L |
| 1.0mol |
| 2.0L |
| 0.40mol |
| 2.0L |
PCl3(g)+Cl2(g)⇌PCl5(g)△H=-93.0kJ•mol-1,
开始(mol/L)1.0 0.5 0
反应(mol/L)0.2 0.2 0.2
平衡(mol/L)0.8 0.3 0.2
化学平衡常数K=
| c(PCl5) |
| c(PCl3).c(Cl2) |
| 0.2 |
| 0.8×0.3 |
| 5 |
| 6 |
故答案为:
| 5 |
| 6 |
(3)生成1mol五氯化磷放出93.0kJ热量,250s时生成n(PCl5)=0.40mol放出热量=0.40mol×93.0kJ/mol=37.2kJ,故答案为:37.2;
(4)a.反应前后气体总质量不变、容器体积不变,根据ρ=
| m |
| V |
b.所有的化学反应只要升高温度正逆反应速率都增大,所以该反应升高温度正逆反应速率都增大,故b正确;
c.350s 时,向该密闭容器中充入氮气,参加反应的各气体分压不变、浓度不变,则化学平衡不移动,故c错误;
d.相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.2molCl2,与原反应相比,相当于减小压强平衡向气体体积增大的方向移动,则生成五氯化磷物质的量小于原来一半,故d正确;
故选abd;
(5)该反应的正反应是放热反应,升高温度化学反应速率加快,反应达到平衡时间缩短,但平衡逆向移动,达到平衡时五氯化磷体积分数降低,所以其图象为
 ,
,故答案为:
 .
.
看了 五氯化磷(PCl5)是有机合...的网友还看了以下:
在平面直角坐标系中 已知三点 A(1.0) B(0.2) C(1.4) 要使四边形abcd为菱形 2020-05-17 …
(1+x)+(1+x)^2+(1+x)^3+.+(1+x)^n=a0+a1*x+a2*x^2+.a 2020-05-20 …
三台计算机A、B、C的ip地址分别为A:192.168.1.155、B:192.168.1.165、 2020-05-31 …
[20分][高一不等式]已知a,b,c∈R+,且a+b+c=1,求证1/a+1/b+1/c≥9已知 2020-06-10 …
已知a,b,c是不全相等的实数,且abc不等0,a^3+b^3+c^3=3abc试求a+b+c的值 2020-06-12 …
高二数学题,帮忙解决,要步骤的(1)设a,b,c属于R,a+b+c=0,abc0.(2)设a,b, 2020-07-22 …
[已知a+b+c=6,且a,b,c>0,求证:(a+1/a)*(b+1/b)*(c+1/c)>=12 2020-10-30 …
有四支温度计,测量范围分别是:A.—10--110°CB.35--42°CC.—20--50°C(1 2020-11-12 …
(6分)有四支温度计,测量范围分别是:A.—10~110°CB.35~42°CC.—20~50°CD 2020-11-12 …
公式换算条件:A=a/255B=b/255C=x/255要求将含有ABC的公式转换成abx的最简化公 2020-11-28 …