早教吧作业答案频道 -->化学-->
工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇.(1)制取H2和CO通常采用:C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是.a.该反应的反应物总能量小于
题目详情
工业常用燃料与水蒸气反应制备H2和CO,再用H2和CO合成甲醇.
(1)制取H2和CO通常采用:C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是___.
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)⇌C(s)+H2O(1)△H=-QkJ•mol-1,则Q<131.4
d.若C(s)+CO2(g)⇌2CO(g)△H1;CO(g)+H2O(g)⇌H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g)
已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
根据表中数据计算:
①0min~2min 内H2的平均反应速率为___.
②达平衡时,CH4的转化率为___.在上述平衡体系中再充入2.00mol甲烷和1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比___(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有___.(填字母)
a.CO的含量保持不变
b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变
d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的.工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过).
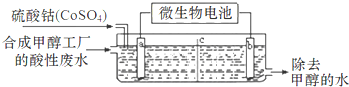
①a电极的名称为___.
②写出除去甲醇的离子方程式___.
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为___.
(1)制取H2和CO通常采用:C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是___.
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g)⇌C(s)+H2O(1)△H=-QkJ•mol-1,则Q<131.4
d.若C(s)+CO2(g)⇌2CO(g)△H1;CO(g)+H2O(g)⇌H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g)
已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
①0min~2min 内H2的平均反应速率为___.
②达平衡时,CH4的转化率为___.在上述平衡体系中再充入2.00mol甲烷和1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比___(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有___.(填字母)
a.CO的含量保持不变
b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变
d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的.工作原理如图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过).

①a电极的名称为___.
②写出除去甲醇的离子方程式___.
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为___.
▼优质解答
答案和解析
(1)a、反应是吸热反应,依据能量守恒分析判断,生成物能量总和大于反应物能量总和,故a正确;
b、标准状况下,上述反应生成1mol H2气体时吸收131.4 kJ的热量,故b错误;
c、若CO(g)+H2(g)⇌C(s)+H2O(1)△H=-QkJ•mol-1,则Q=131.4,故c错误;
d、根据盖斯定律,若C(s)+CO2(g)⇌2CO(g)△H1;CO(g)+H2O(g)⇌H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol-1,故d正确;
故答案为:ad;
(2)①0min~2min 内H2的平均反应速率为
=0.18mol•L-1•min-1,故答案为:0.18mol•L-1•min-1;
②4min时,参加反应的甲烷为2mol-1.6mol=0.4mol,生成氢气为0.4mol×3=1.2mol,达到平衡,此时甲烷的转化率为
×100%=20%;在上述平衡体系中再充入2.00mol甲烷和1.00mol 水蒸气,压强增大,平衡向逆反应方向移动,达到新平衡时H2的体积分数与原平衡相比变小;
a.CO的含量保持不变,反应达到平衡;
b.容器中c(CH4)与c(CO)相等,不一定平衡;
c.容器中混合气体的密度一直不变,不是平衡状态的标志;
d.3ν正(CH4)=ν逆(H2),反应达到平衡;
故答案为:20%;变小;ad;
(3)①电极a,Co2+被氧化成Co3+,发生氧化反应,为电解池的阳极;故答案为:阳极
②甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+,溶液呈酸性,则生成物中含有氢离子,所以该反应离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,故答案为:6Co3++CH3OH+H2O=6Co2++CO2+6H+.
③微生物电池是绿色酸性燃料电池,氧气在正极放电4H++O2+4e-=2H2O,故答案为:4H++O2+4e-=2H2O.
b、标准状况下,上述反应生成1mol H2气体时吸收131.4 kJ的热量,故b错误;
c、若CO(g)+H2(g)⇌C(s)+H2O(1)△H=-QkJ•mol-1,则Q=131.4,故c错误;
d、根据盖斯定律,若C(s)+CO2(g)⇌2CO(g)△H1;CO(g)+H2O(g)⇌H2(g)+CO2(g)△H2 则:△H1+△H2=+131.4kJ•mol-1,故d正确;
故答案为:ad;
(2)①0min~2min 内H2的平均反应速率为
| 0.72mol |
| 2L•2min |
②4min时,参加反应的甲烷为2mol-1.6mol=0.4mol,生成氢气为0.4mol×3=1.2mol,达到平衡,此时甲烷的转化率为
| 0.4mol |
| 2mol |
a.CO的含量保持不变,反应达到平衡;
b.容器中c(CH4)与c(CO)相等,不一定平衡;
c.容器中混合气体的密度一直不变,不是平衡状态的标志;
d.3ν正(CH4)=ν逆(H2),反应达到平衡;
故答案为:20%;变小;ad;
(3)①电极a,Co2+被氧化成Co3+,发生氧化反应,为电解池的阳极;故答案为:阳极
②甲醇被氧化生成二氧化碳,Co3+被还原生成Co2+,溶液呈酸性,则生成物中含有氢离子,所以该反应离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,故答案为:6Co3++CH3OH+H2O=6Co2++CO2+6H+.
③微生物电池是绿色酸性燃料电池,氧气在正极放电4H++O2+4e-=2H2O,故答案为:4H++O2+4e-=2H2O.
看了 工业常用燃料与水蒸气反应制备...的网友还看了以下:
氟里昂对臭氧起什么作用是不是催化剂作用.Cl+O3→O2+ClOClO+O→O2+Cl,这个反应式 2020-04-11 …
下列各项中注音有误的一项是()A.顺蔓(wàn)摸瓜犯而不校(jiào)反躬自省(xǐng)B.未 2020-04-22 …
关于化合价的问题,O的化合价为-2,是不是也就是说在O在反应中要得到两个负电荷?和O反应的那种物质 2020-05-20 …
( 24 )通道是一种A ) I/O 设备 B ) I/O 控制器 C ) I/O 处理机 D )设 2020-05-23 …
通道是一种________。A.I/O设备B.I/O控制器C.I/O处理机D.设备控制器 2020-05-23 …
为尽量减少主机对繁杂FO控制的干预,I/O控制方式在不断地发展,如下对I/O控制方式的叙述正确的是( 2020-05-23 …
通道是一种A.I/O设备B.I/O控制器C.I/O处理机D.设备控制器 2020-05-24 …
点亮九宫格问题每个格子有正反两面,改变一个格子相邻的格子正反也会发生变化,例如改变1,1,2,4会改 2020-11-02 …
下列各项中注音有误的一项是A.顺蔓(wàn)摸瓜犯而不校(jiào)反躬自省(xǐng)B.未雨绸缪 2020-12-24 …
下列各项中注音有误的一项是()A、顺蔓(wàn)摸瓜犯而不校(jiào)反躬自省(xǐng)B、未雨 2020-12-24 …