早教吧作业答案频道 -->化学-->
甲醇是未来重要的绿色能源之一,以CH4和H2O为原料,通过下列反应来制备甲醇.Ⅰ、CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+206.0KJ/molⅡ、CO(g)+2H2(g)⇌CH3OH(g)△H=-129.0KJ/mol(1)CH4(g)与
题目详情
甲醇是未来重要的绿色能源之一,以CH4和H2O为原料,通过下列反应来制备甲醇.
Ⅰ、CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+206.0KJ/mol
Ⅱ、CO(g)+2H2(g)⇌CH3OH(g)△H=-129.0KJ/mol
(1)CH4(g)与H2(g)反应生成CH3OH(g)和H2(g)的热化学方程式为___,根据化学反应原理,此反应采用和条件为___.(从下列选项中选填编号)
a.高温、高压 b.高温、常压 c.常温、常压 d.常温、高压
(2)将CH4和H2O(g)通入一定容积的密闭容器中,在一定温度下发生反应Ⅰ和Ⅱ,测得各物质的浓度变化如图1(部分物质未画出)
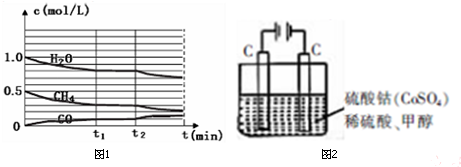
①t1时刻达到平衡时,c(CH3OH)=___mol/L;
②此条件下反应Ⅰ的平衡常数为___(结果保留小数点后3位);
③若t2时刻改变某一条件,各物质的浓度变化如图所示,则改变的条件可能为:___(任答出一种合理的改变即可)
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化,实验室用如图2模拟上述过程:
①写出阳极电极反应式___;
②写出除去甲醇的离子方程式___.
Ⅰ、CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+206.0KJ/mol
Ⅱ、CO(g)+2H2(g)⇌CH3OH(g)△H=-129.0KJ/mol
(1)CH4(g)与H2(g)反应生成CH3OH(g)和H2(g)的热化学方程式为___,根据化学反应原理,此反应采用和条件为___.(从下列选项中选填编号)
a.高温、高压 b.高温、常压 c.常温、常压 d.常温、高压
(2)将CH4和H2O(g)通入一定容积的密闭容器中,在一定温度下发生反应Ⅰ和Ⅱ,测得各物质的浓度变化如图1(部分物质未画出)

①t1时刻达到平衡时,c(CH3OH)=___mol/L;
②此条件下反应Ⅰ的平衡常数为___(结果保留小数点后3位);
③若t2时刻改变某一条件,各物质的浓度变化如图所示,则改变的条件可能为:___(任答出一种合理的改变即可)
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化,实验室用如图2模拟上述过程:
①写出阳极电极反应式___;
②写出除去甲醇的离子方程式___.
▼优质解答
答案和解析
(1)已知①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol,②CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol,由盖斯定律可知①-②得到CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0kJ/mol,反应前后气体体积不变,反应是吸热反应,使反应正向进行的适宜条件是高温常压,增大压强对反应速率增大,但平衡不动不能增加生成物产率,故选b;
故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0kJ/mol;b;
(2)①将CH4和H2O(g)通入一定容积的密闭容器中,在一定温度下发生反应Ⅰ和Ⅱ,图象中纵轴上每个单位为0.1mol/L,起始量c(H2O)=1.0mol/L,c(CH4)=0.5mol/L,t1平衡状态下c(H2O)=0.8mol/L,c(CH4)=0.3mol/L,c(CO)=0.1mol/L,
Ⅰ、CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+206.0KJ/mol
起始量(mol/L) 0.5 1 0 0
变化量(mol/L) 0.2 0.2 0.2 0.6
平衡量(mol/L) 0.3 0.8 0.2 0.6
Ⅱ、CO(g)+2H2(g)⇌CH3OH(g)△H=-129.0KJ/mol
起始量(mol/L) 0.2 0.6 0
变化量(mol/L) 0.1 0.2 0.1
平衡量(mol/L) 0.1 0.4 0.1
所以平衡状态甲醇浓度为0.1mol/L,
故答案为:0.1;
②结合上述计算得到平衡状态下物质的平衡浓度,所以反应Ⅰ平衡常数K=
=0.027,
故答案为:0.027;
③分析图象可知,t2时刻改变某一条件,甲烷、水蒸气浓度减小,一氧化碳浓度增大,说明平衡正向进行,结合影响平衡因素和反应特征,反应是放热反应,分离生成物、降低温度平衡正向进行;
故答案为:降低温度或冷凝液化分离出甲醇;
(3)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
故答案为:Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0kJ/mol;b;
(2)①将CH4和H2O(g)通入一定容积的密闭容器中,在一定温度下发生反应Ⅰ和Ⅱ,图象中纵轴上每个单位为0.1mol/L,起始量c(H2O)=1.0mol/L,c(CH4)=0.5mol/L,t1平衡状态下c(H2O)=0.8mol/L,c(CH4)=0.3mol/L,c(CO)=0.1mol/L,
Ⅰ、CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+206.0KJ/mol
起始量(mol/L) 0.5 1 0 0
变化量(mol/L) 0.2 0.2 0.2 0.6
平衡量(mol/L) 0.3 0.8 0.2 0.6
Ⅱ、CO(g)+2H2(g)⇌CH3OH(g)△H=-129.0KJ/mol
起始量(mol/L) 0.2 0.6 0
变化量(mol/L) 0.1 0.2 0.1
平衡量(mol/L) 0.1 0.4 0.1
所以平衡状态甲醇浓度为0.1mol/L,
故答案为:0.1;
②结合上述计算得到平衡状态下物质的平衡浓度,所以反应Ⅰ平衡常数K=
| 0.1×0.43 |
| 0.3×0.8 |
故答案为:0.027;
③分析图象可知,t2时刻改变某一条件,甲烷、水蒸气浓度减小,一氧化碳浓度增大,说明平衡正向进行,结合影响平衡因素和反应特征,反应是放热反应,分离生成物、降低温度平衡正向进行;
故答案为:降低温度或冷凝液化分离出甲醇;
(3)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
故答案为:Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
看了 甲醇是未来重要的绿色能源之一...的网友还看了以下:
下列关于世界上人口迁移的表述中正确的是()A.近几十年来,大量人口从农村涌进城市B.从整个世界来看 2020-05-13 …
下列关于世界上人口迁移的表述中正确的是[]A.近几十年来,大量人口从农村涌进城市B.从整个世界来看 2020-05-16 …
盛年不重来的下一句是什么拜托了各位时光的流逝 2020-06-08 …
盛年不重来的下一句是什么 2020-06-08 …
下列()记账错误,难以通过试算平衡来检查发现。A.串户B.漏登某一账户发生额C.重复登下列()记账 2020-06-15 …
等差数列如果知道SN,an,d我怎么求A1和N,谁能帮我取个数出来列下 2020-07-23 …
下列关于世界上人口迁移的表述中正确的是()A.近几十年来,大量人口从农村涌进城市B.从整个世界来看 2020-07-28 …
依此填入下列各句横线处的词语,最恰当的一组是()①最近两年来,各地都把经营性使用权招标拍卖工作作为经 2020-12-21 …
依此填入下列各句横线处的词语,最恰当的一组是()①最近两年来,各地都把经营性使用权招标拍卖工作作为经 2020-12-21 …
本人数学不大好许多题一时半会想不出来,列下式子,在一块长70m,宽50m的长方形绿地四周有一条宽度相 2021-01-16 …