早教吧作业答案频道 -->化学-->
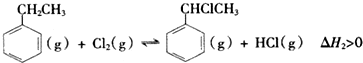
乙苯是一种用途广泛的有机原料,可制备多种化工产品.(一)制备苯乙烯(原理如反应I所示):I.△H=+124kJ•mol-1(1)部分化学键的键能如表所示:化学键C-HC-CC═CH-H
题目详情
乙苯是一种用途广泛的有机原料,可制备多种化工产品.
(一)制备苯乙烯(原理如反应I所示):
I.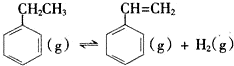 △H=+124kJ•mol-1
△H=+124kJ•mol-1
(1)部分化学键的键能如表所示:
根据反应I的能量变化,计算x=___.
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.用化学平衡理论解释通入水蒸气的原因为___.
(3)从体系自由能变化的角度分析,反应I在___(填“高温”或“低温”)下有利于其自发进行.
(二)制备α-氯乙基苯(原理如反应II所示):
II.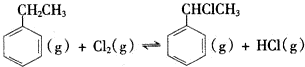 △H2>0
△H2>0
(4)T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,乙苯和Cl2的物质的量浓度(c)随时间(t)变化的曲线如图l所示:
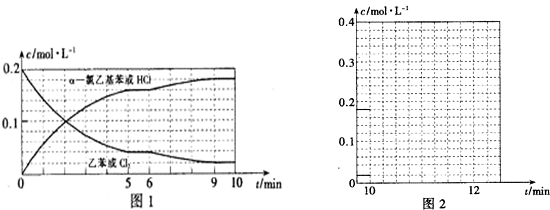
①0-5min内,以HC1表示的该反应速率v(HCl)=___.
②T℃时,该反应的平衡常数K=___.
③6min时,改变的外界条件为___.
④10min时,保持其他条件不变,再向容器中充人1moI乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,12min时达到新平衡.在图2中画出10-12 min,Cl2和HCl的浓度变化曲线(曲线上标明Cl2和HCl);0-5min和0-12min时间段,Cl2的转化率分别用α1、α2 表示,则αl___α2(填“>”、“<”或“=”).
(一)制备苯乙烯(原理如反应I所示):
I.
 △H=+124kJ•mol-1
△H=+124kJ•mol-1(1)部分化学键的键能如表所示:
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.用化学平衡理论解释通入水蒸气的原因为___.
(3)从体系自由能变化的角度分析,反应I在___(填“高温”或“低温”)下有利于其自发进行.
(二)制备α-氯乙基苯(原理如反应II所示):
II.
 △H2>0
△H2>0(4)T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,乙苯和Cl2的物质的量浓度(c)随时间(t)变化的曲线如图l所示:

①0-5min内,以HC1表示的该反应速率v(HCl)=___.
②T℃时,该反应的平衡常数K=___.
③6min时,改变的外界条件为___.
④10min时,保持其他条件不变,再向容器中充人1moI乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,12min时达到新平衡.在图2中画出10-12 min,Cl2和HCl的浓度变化曲线(曲线上标明Cl2和HCl);0-5min和0-12min时间段,Cl2的转化率分别用α1、α2 表示,则αl___α2(填“>”、“<”或“=”).
▼优质解答
答案和解析
(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,设C=C键能为X,则△H=(5×412+348-3×412-X-436)kJ•mol-1=124kJ•mol-1,解得X=612KJ/mol;
故答案为:612;
(2)正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动;
故答案为:正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率;
(3) △H=+124kJ•mol-1,反应为气体体积增大的吸热反应,△H>0,△S>0,满足△H-T△S<0,需要高温条件下,
△H=+124kJ•mol-1,反应为气体体积增大的吸热反应,△H>0,△S>0,满足△H-T△S<0,需要高温条件下,
故答案为:高温;
(4)①T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,依据题干条件可知,C(HCl)=0.16mol/L,v=
=
=0.032 mol•L-1•min-1,
故答案为:0.032 mol•L-1•min-1;
②5min时达到平衡,依据题干条件可知,C(HCl)=0.16mol/L,n(HCl)=1.6mol,
起始(mol) 2 2 0 0
转化(mol) 1.6 1.6 1.6 1.6
平衡(mol) 0.4 0.4 1.6 1.6
平衡常数为K=
=16,
故答案为:16;
③制备α-氯乙基苯的正反应为吸热反应,反应前后气体的体积不变,6min时,乙苯、Cl2的浓度在减小,而α-氯乙基苯和HCl的浓度在增加,反应向正反应方向移动,只能是升高温度,
故答案为:升高温度;
④10min时,乙苯、Cl2、α-氯乙基苯和 HCl的物质的量浓度分别为:0.02mol/L、0.02mol/L、0.18mol/L、0.18mol/L,平衡常数为K=
=81,此时乙苯、Cl2、α-氯乙基苯和 HCl的物质的量浓度比为:1:1:9:9,保持其他条件不变,再向容器中充人1mol 乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,相当于增加反应物的浓度,平衡正向移动,则α1<α2,设转化的乙苯物质的量浓度为x,则

起始(mol/L) 0.12 0.12 0.28 0.28
转化(mol/L) x x x x
平衡(mol/L) 0.12-x 0.12-x 0.28+x 0.28+x
平衡常数为K=
=81,解得x=0.08mol/L,则12min时,乙苯、Cl2物质的量浓度都为0.12-x=0.04mol/L,α-氯乙基苯和 HCl的物质的量浓度都为:0.28+x=0.36mol/L,浓度变化曲线如图: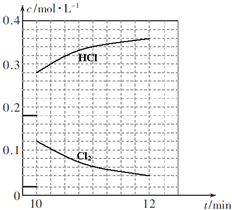 ,
,
故答案为: ;<.
;<.
故答案为:612;
(2)正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动;
故答案为:正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率;
(3)
 △H=+124kJ•mol-1,反应为气体体积增大的吸热反应,△H>0,△S>0,满足△H-T△S<0,需要高温条件下,
△H=+124kJ•mol-1,反应为气体体积增大的吸热反应,△H>0,△S>0,满足△H-T△S<0,需要高温条件下,故答案为:高温;
(4)①T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,依据题干条件可知,C(HCl)=0.16mol/L,v=
| ||
| △t |
| 0.16mol/L |
| 5min |
故答案为:0.032 mol•L-1•min-1;
②5min时达到平衡,依据题干条件可知,C(HCl)=0.16mol/L,n(HCl)=1.6mol,

起始(mol) 2 2 0 0
转化(mol) 1.6 1.6 1.6 1.6
平衡(mol) 0.4 0.4 1.6 1.6
平衡常数为K=
| ||||
|
故答案为:16;
③制备α-氯乙基苯的正反应为吸热反应,反应前后气体的体积不变,6min时,乙苯、Cl2的浓度在减小,而α-氯乙基苯和HCl的浓度在增加,反应向正反应方向移动,只能是升高温度,
故答案为:升高温度;
④10min时,乙苯、Cl2、α-氯乙基苯和 HCl的物质的量浓度分别为:0.02mol/L、0.02mol/L、0.18mol/L、0.18mol/L,平衡常数为K=
| 0.18×0.18 |
| 0.02×0.02 |

起始(mol/L) 0.12 0.12 0.28 0.28
转化(mol/L) x x x x
平衡(mol/L) 0.12-x 0.12-x 0.28+x 0.28+x
平衡常数为K=
| (0.28+x)(0.28+x) |
| (0.12-x)(0.12-x) |
 ,
,故答案为:
 ;<.
;<.
看了 乙苯是一种用途广泛的有机原料...的网友还看了以下:
还是matlab画图问题,要输入一个变量的clc; clear all; h=input('h=' 2020-05-16 …
一个mathematica程序添加作图语句Clear[x,y,n,h,S1,S2,S3,S4,i] 2020-05-16 …
焓变指的是H(反应产物)—H(反应物)可是为什么又会等于反应前物质的总键能减去反应后的物质的总键能 2020-06-07 …
H-H键和H-F键哪个键能大,为什么? 2020-07-07 …
已知断开或形成1mol化学键吸收或放出的能量称为化学键的键能,如H—H键的键能为436kJ·mol 2020-07-07 …
已知各破坏1molN≡N键、H-H键和N-H键分别需要吸收的能量为946kJ、436kJ、391k 2020-07-18 …
部分化学键的键能数据如表:化学键H-HF-FH-FH-ClH-1E(kJ/mol)436.0157 2020-07-21 …
推断题:现有如下反应(反应条件均不给),推断物质⑴A→B+C+D⑵C+E→C+F+D⑶D+G→H⑷ 2020-07-30 …
A.悲怆(chuànɡ)证券(juàn)情不自禁(jìn)B.鸟瞰(kàn)招徕(lái)如火如荼( 2020-12-21 …
氨催化氧化是硝酸工业的基础,按要求回答下列问题:(1)NH3与O2可生成NO,其热化学方程式可表示为 2021-02-16 …