早教吧作业答案频道 -->化学-->
固体(NH4)2Al(SO4)2•12H2O在加热时,固体残留率随温度的变化如图所示.(1)取A物质溶于水形成溶液,加入过量NaOH溶液混合加热,反应的离子方程式为;(2)B物质的化学式为;(3
题目详情
固体(NH4)2 Al(SO4)2•12H2O在加热时,固体残留率随温度的变化如图所示.
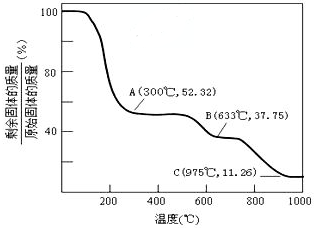
(1)取A物质溶于水形成溶液,加入过量NaOH溶液混合加热,反应的离子方程式为___;
(2)B物质的化学式为___;
(3)取B物质,于975℃灼烧得到的主要产物是C和一种氧化性气体,该反应的化学方程式为___,C与分别足量NaOH溶液和稀硫酸反应,消耗两者物质的量之比为___;
(4)常温下,在0.10mol•L-1B的溶液中加入氢氧化钠稀溶液充分搅拌有Al (OH)3沉淀生成,当溶液的pH=10时,c(Al3+)=___mol•L-1(KSp[Al (OH)3]=3×10-34).固体(NH4)2 Al(SO4)2•12H2O在加热时,固体残留率随温度的变化如图所示.

(1)取A物质溶于水形成溶液,加入过量NaOH溶液混合加热,反应的离子方程式为___;
(2)B物质的化学式为___;
(3)取B物质,于975℃灼烧得到的主要产物是C和一种氧化性气体,该反应的化学方程式为___,C与分别足量NaOH溶液和稀硫酸反应,消耗两者物质的量之比为___;
(4)常温下,在0.10mol•L-1B的溶液中加入氢氧化钠稀溶液充分搅拌有Al (OH)3沉淀生成,当溶液的pH=10时,c(Al3+)=___mol•L-1(KSp[Al (OH)3]=3×10-34).42422

-13c3+-1Sp3-34

(1)取A物质溶于水形成溶液,加入过量NaOH溶液混合加热,反应的离子方程式为___;
(2)B物质的化学式为___;
(3)取B物质,于975℃灼烧得到的主要产物是C和一种氧化性气体,该反应的化学方程式为___,C与分别足量NaOH溶液和稀硫酸反应,消耗两者物质的量之比为___;
(4)常温下,在0.10mol•L-1B的溶液中加入氢氧化钠稀溶液充分搅拌有Al (OH)3沉淀生成,当溶液的pH=10时,c(Al3+)=___mol•L-1(KSp[Al (OH)3]=3×10-34).固体(NH4)2 Al(SO4)2•12H2O在加热时,固体残留率随温度的变化如图所示.

(1)取A物质溶于水形成溶液,加入过量NaOH溶液混合加热,反应的离子方程式为___;
(2)B物质的化学式为___;
(3)取B物质,于975℃灼烧得到的主要产物是C和一种氧化性气体,该反应的化学方程式为___,C与分别足量NaOH溶液和稀硫酸反应,消耗两者物质的量之比为___;
(4)常温下,在0.10mol•L-1B的溶液中加入氢氧化钠稀溶液充分搅拌有Al (OH)3沉淀生成,当溶液的pH=10时,c(Al3+)=___mol•L-1(KSp[Al (OH)3]=3×10-34).42422

-13c3+-1Sp3-34
▼优质解答
答案和解析
(1)分析固体残留率随温度的变化图可知,M(A)=M【NH44Al(SO44)22】×53.32%=237,故A为NH44Al(SO44)22,取A物质溶于水形成溶液,加入过量NaOH溶液混合加热,反应的离子方程式为:NH44+++Al3+3++5OH--
AlO2-+NH3↑+3H2O,
故答案为:NH4++Al3++5OH-
AlO2-+NH3↑+3H2O;
(2)同理,M(B)=M【NH4Al(SO4)2】×37.75%=171,故其只可能是:2NH4Al(SO4)2~Al2O3,结合原子守恒得到B为Al2(SO4)3,
故答案为:Al2(SO4)3;
(3)M(C)=M【NH4Al(SO4)2】×11.26%=51,故其只可能是:2NH4Al(SO4)2~Al2O3,故C为Al2O3.NH4Al(SO4)2溶液,加入过量NaOH溶液混合加热,离子方程式为:NH4++Al3++5OH-
AlO2-+NH3↑+3H2O;B物质于975℃灼烧得到的氧化性气体为SO3,反应的化学方程式为:Al2(SO4)3
Al2O3+3SO3↑,C为Al2O3与分别足量NaOH溶液和稀硫酸反应,Al2O3+2NaOH=2NaAlO2+H2O,Al2O3+3H2SO4=Al2(SO4)2+3H2O,消耗两者物质的量之比为2:3,
故答案为:Al2(SO4)3
Al2O3+3SO3↑;2:3;
(4)根据溶度积的概念可以直接计算.pH=10时,c(OH-)=10-4,由c(Al 3+)•c3(OH-)=KSp[Al(OH)3],可得c(Al 3+)=
=3×10-22mol•L-1,
故答案为:3×10-22.
△ △ △ △ AlO22--+NH33↑+3H22O,
故答案为:NH44+++Al3+3++5OH--
AlO2-+NH3↑+3H2O;
(2)同理,M(B)=M【NH4Al(SO4)2】×37.75%=171,故其只可能是:2NH4Al(SO4)2~Al2O3,结合原子守恒得到B为Al2(SO4)3,
故答案为:Al2(SO4)3;
(3)M(C)=M【NH4Al(SO4)2】×11.26%=51,故其只可能是:2NH4Al(SO4)2~Al2O3,故C为Al2O3.NH4Al(SO4)2溶液,加入过量NaOH溶液混合加热,离子方程式为:NH4++Al3++5OH-
AlO2-+NH3↑+3H2O;B物质于975℃灼烧得到的氧化性气体为SO3,反应的化学方程式为:Al2(SO4)3
Al2O3+3SO3↑,C为Al2O3与分别足量NaOH溶液和稀硫酸反应,Al2O3+2NaOH=2NaAlO2+H2O,Al2O3+3H2SO4=Al2(SO4)2+3H2O,消耗两者物质的量之比为2:3,
故答案为:Al2(SO4)3
Al2O3+3SO3↑;2:3;
(4)根据溶度积的概念可以直接计算.pH=10时,c(OH-)=10-4,由c(Al 3+)•c3(OH-)=KSp[Al(OH)3],可得c(Al 3+)=
=3×10-22mol•L-1,
故答案为:3×10-22.
△ △ △ △ AlO22--+NH33↑+3H22O;
(2)同理,M(B)=M【NH44Al(SO44)22】×37.75%=171,故其只可能是:2NH44Al(SO44)22~Al22O33,结合原子守恒得到B为Al22(SO44)33,
故答案为:Al22(SO44)33;
(3)M(C)=M【NH44Al(SO44)22】×11.26%=51,故其只可能是:2NH44Al(SO44)22~Al22O33,故C为Al22O33.NH44Al(SO44)22溶液,加入过量NaOH溶液混合加热,离子方程式为:NH44+++Al3+3++5OH--
AlO2-+NH3↑+3H2O;B物质于975℃灼烧得到的氧化性气体为SO3,反应的化学方程式为:Al2(SO4)3
Al2O3+3SO3↑,C为Al2O3与分别足量NaOH溶液和稀硫酸反应,Al2O3+2NaOH=2NaAlO2+H2O,Al2O3+3H2SO4=Al2(SO4)2+3H2O,消耗两者物质的量之比为2:3,
故答案为:Al2(SO4)3
Al2O3+3SO3↑;2:3;
(4)根据溶度积的概念可以直接计算.pH=10时,c(OH-)=10-4,由c(Al 3+)•c3(OH-)=KSp[Al(OH)3],可得c(Al 3+)=
=3×10-22mol•L-1,
故答案为:3×10-22.
△ △ △ △ AlO22--+NH33↑+3H22O;B物质于975℃灼烧得到的氧化性气体为SO33,反应的化学方程式为:Al22(SO44)33
Al2O3+3SO3↑,C为Al2O3与分别足量NaOH溶液和稀硫酸反应,Al2O3+2NaOH=2NaAlO2+H2O,Al2O3+3H2SO4=Al2(SO4)2+3H2O,消耗两者物质的量之比为2:3,
故答案为:Al2(SO4)3
Al2O3+3SO3↑;2:3;
(4)根据溶度积的概念可以直接计算.pH=10时,c(OH-)=10-4,由c(Al 3+)•c3(OH-)=KSp[Al(OH)3],可得c(Al 3+)=
=3×10-22mol•L-1,
故答案为:3×10-22.
975℃ 975℃ 975℃ 975℃ Al22O33+3SO33↑,C为Al22O33与分别足量NaOH溶液和稀硫酸反应,Al22O33+2NaOH=2NaAlO22+H22O,Al22O33+3H22SO44=Al22(SO44)22+3H22O,消耗两者物质的量之比为2:3,
故答案为:Al22(SO44)33
Al2O3+3SO3↑;2:3;
(4)根据溶度积的概念可以直接计算.pH=10时,c(OH-)=10-4,由c(Al 3+)•c3(OH-)=KSp[Al(OH)3],可得c(Al 3+)=
=3×10-22mol•L-1,
故答案为:3×10-22.
975℃ 975℃ 975℃ 975℃ Al22O33+3SO33↑;2:3;
(4)根据溶度积的概念可以直接计算.pH=10时,cc(OH--)=10-4-4,由cc(Al 3+ 3+)•cc33(OH--)=KSpSp[Al(OH)33],可得c(Al 3+ 3+)=
=3×10-22mol•L-1,
故答案为:3×10-22.
3×10-34 10-12 3×10-34 3×10-34 3×10-34-3410-12 10-12 10-12-12=3×10-22-22mol•L-1-1,
故答案为:3×10-22-22.
| ||
故答案为:NH4++Al3++5OH-
| ||
(2)同理,M(B)=M【NH4Al(SO4)2】×37.75%=171,故其只可能是:2NH4Al(SO4)2~Al2O3,结合原子守恒得到B为Al2(SO4)3,
故答案为:Al2(SO4)3;
(3)M(C)=M【NH4Al(SO4)2】×11.26%=51,故其只可能是:2NH4Al(SO4)2~Al2O3,故C为Al2O3.NH4Al(SO4)2溶液,加入过量NaOH溶液混合加热,离子方程式为:NH4++Al3++5OH-
| ||
| ||
故答案为:Al2(SO4)3
| ||
(4)根据溶度积的概念可以直接计算.pH=10时,c(OH-)=10-4,由c(Al 3+)•c3(OH-)=KSp[Al(OH)3],可得c(Al 3+)=
| 3×10-34 |
| 10-12 |
故答案为:3×10-22.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.故答案为:NH44+++Al3+3++5OH--
| ||
(2)同理,M(B)=M【NH4Al(SO4)2】×37.75%=171,故其只可能是:2NH4Al(SO4)2~Al2O3,结合原子守恒得到B为Al2(SO4)3,
故答案为:Al2(SO4)3;
(3)M(C)=M【NH4Al(SO4)2】×11.26%=51,故其只可能是:2NH4Al(SO4)2~Al2O3,故C为Al2O3.NH4Al(SO4)2溶液,加入过量NaOH溶液混合加热,离子方程式为:NH4++Al3++5OH-
| ||
| ||
故答案为:Al2(SO4)3
| ||
(4)根据溶度积的概念可以直接计算.pH=10时,c(OH-)=10-4,由c(Al 3+)•c3(OH-)=KSp[Al(OH)3],可得c(Al 3+)=
| 3×10-34 |
| 10-12 |
故答案为:3×10-22.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.(2)同理,M(B)=M【NH44Al(SO44)22】×37.75%=171,故其只可能是:2NH44Al(SO44)22~Al22O33,结合原子守恒得到B为Al22(SO44)33,
故答案为:Al22(SO44)33;
(3)M(C)=M【NH44Al(SO44)22】×11.26%=51,故其只可能是:2NH44Al(SO44)22~Al22O33,故C为Al22O33.NH44Al(SO44)22溶液,加入过量NaOH溶液混合加热,离子方程式为:NH44+++Al3+3++5OH--
| ||
| ||
故答案为:Al2(SO4)3
| ||
(4)根据溶度积的概念可以直接计算.pH=10时,c(OH-)=10-4,由c(Al 3+)•c3(OH-)=KSp[Al(OH)3],可得c(Al 3+)=
| 3×10-34 |
| 10-12 |
故答案为:3×10-22.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.
| ||
故答案为:Al2(SO4)3
| ||
(4)根据溶度积的概念可以直接计算.pH=10时,c(OH-)=10-4,由c(Al 3+)•c3(OH-)=KSp[Al(OH)3],可得c(Al 3+)=
| 3×10-34 |
| 10-12 |
故答案为:3×10-22.
| ||
| 975℃ |
. |
| 975℃ |
. |
| 975℃ |
. |
| 975℃ |
. |
.
.
.
.
.故答案为:Al22(SO44)33
| ||
(4)根据溶度积的概念可以直接计算.pH=10时,c(OH-)=10-4,由c(Al 3+)•c3(OH-)=KSp[Al(OH)3],可得c(Al 3+)=
| 3×10-34 |
| 10-12 |
故答案为:3×10-22.
| ||
| 975℃ |
. |
| 975℃ |
. |
| 975℃ |
. |
| 975℃ |
. |
.
.
.
.
.(4)根据溶度积的概念可以直接计算.pH=10时,cc(OH--)=10-4-4,由cc(Al 3+ 3+)•cc33(OH--)=KSpSp[Al(OH)33],可得c(Al 3+ 3+)=
| 3×10-34 |
| 10-12 |
故答案为:3×10-22.
| 3×10-34 |
| 10-12 |
故答案为:3×10-22-22.
看了 固体(NH4)2Al(SO4...的网友还看了以下:
配制300g质量分数为3%的氯化钠溶液,实验操作如下:(1)称量氯化钠固体的质量:在图1中分别标出 2020-05-14 …
在中国境内有住所或者无住所,而在境内居住满1年的个人,从中国( )取得的所得应依法缴纳个 2020-05-19 …
高一政治必修一第八课关于个人所得税的一个问题一个外国人,在我国无住所但居住满一年后,返回自己的国家 2020-05-20 …
往100mlKBr溶液中通入足量Cl2,将所得溶液蒸干并灼烧固体,冷却后称得固体质量为7.45g求 2020-05-21 …
固定资产投资效益是指固定资产投资活动所取得的有效成果与所消耗或所占用劳动量之间的对 2020-05-21 …
为了验证固定资产的所有权,审计人员应当采取的审计程序是: A.对固定资产进行监盘 B.检 2020-05-21 …
个人所得税纳税人的规定中,中国居民要就其从境内、境外取得的所得,或称全世界范围的所得 2020-05-22 …
是指个人因其作品以图书、报刊形式出版、发表而取得的所得。A.劳务报酬所得B.稿酬所得C.工资、薪 2020-05-22 …
对中国境内居民的境外取得的所得,我国不征收个人所得税。( ) 2020-05-30 …
在中国境内无住所又不居住或者无住所而在境内居住不满1年的个人,从中国境内取得的所得, 2020-05-30 …