I.类比法是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3但当铁过量时,产物是Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当
I . 类比法是化学学习中常用的方法,已知硝酸能把铁氧化成 Fe(NO 3 ) 3 但当铁过量时,产物是 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
⑴ 提出假设:
假设 1 :该固体物质是 FeCl 2
假设 2 :该固体物质是 FeCl 3
假设 3 :该固体物质是
⑵ 设计实验方案:
取少量固体物质置于烧杯中,加适量水溶解,得到溶液 A ,然后取两份 A 溶液分别进行实验,实验现象与结论如下表:
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN 溶液 |
| 固体物质中有 FeCl 3 |
| 在 KMnO 4 溶液中加少量 A 溶液 | KmnO 4 溶液颜色无明显变化 | 固体物质中不含 |
Ⅱ. 电子工业常用 30% 的 FeCl 3 溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得 FeCl 3 溶液,设计了下列实验步骤:
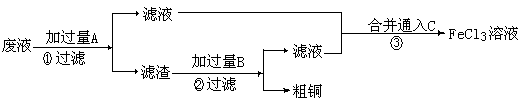
⑶① 写出一个能证明还原性 Fe 比 Cu 强的离子方程式: ,该反应在上图步骤 中发生。
②甲、乙、丙、丁四位同学利用上述反应原理,分别设计的原电池如下图所示:
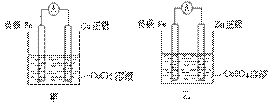
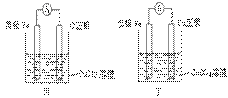
四位同学的设计的原电池装置图,符合上述反应原理的是 。
③ 请写出正、负极的电解反应式:
正极: 、负极: (电极反应式)。
⑷上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式
I . 类比法是化学学习中常用的方法,已知硝酸能把铁氧化成 Fe(NO 3 ) 3 但当铁过量时,产物是 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
⑴ 提出假设:
假设 1 :该固体物质是 FeCl 2
假设 2 :该固体物质是 FeCl 3
假设 3 :该固体物质是
⑵ 设计实验方案:
取少量固体物质置于烧杯中,加适量水溶解,得到溶液 A ,然后取两份 A 溶液分别进行实验,实验现象与结论如下表:
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN 溶液 |
| 固体物质中有 FeCl 3 |
| 在 KMnO 4 溶液中加少量 A 溶液 | KmnO 4 溶液颜色无明显变化 | 固体物质中不含 |
Ⅱ. 电子工业常用 30% 的 FeCl 3 溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得 FeCl 3 溶液,设计了下列实验步骤:

⑶① 写出一个能证明还原性 Fe 比 Cu 强的离子方程式: ,该反应在上图步骤 中发生。
②甲、乙、丙、丁四位同学利用上述反应原理,分别设计的原电池如下图所示:


四位同学的设计的原电池装置图,符合上述反应原理的是 。
③ 请写出正、负极的电解反应式:
正极: 、负极: (电极反应式)。
⑷上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式
I . 类比法是化学学习中常用的方法,已知硝酸能把铁氧化成 Fe(NO 3 ) 3 但当铁过量时,产物是 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
I . 类比法是化学学习中常用的方法,已知硝酸能把铁氧化成 Fe(NO 3 ) 3 但当铁过量时,产物是 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: . 类比法是化学学习中常用的方法,已知硝酸能把铁氧化成 Fe(NO 3 ) 3 但当铁过量时,产物是 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: 类比法是化学学习中常用的方法,已知硝酸能把铁氧化成 Fe(NO 3 ) 3 但当铁过量时,产物是 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: Fe(NO 3 ) 3 但当铁过量时,产物是 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: 3 3 Fe(NO 3 ) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: 3 2 Cl 2 足量时生称 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: 2 FeCl 3 当铁粉过量时产物是 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: 3 FeCl 2 为了验证该观点是否正确,该同学将一定量的铁粉与 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: 2 Cl 2 恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下: 2⑴ 提出假设:
⑴ 提出假设: 提出假设:假设 1 :该固体物质是 FeCl 2
假设 1 :该固体物质是 FeCl 2 1 :该固体物质是 FeCl 2 FeCl 2 2假设 2 :该固体物质是 FeCl 3
假设 2 :该固体物质是 FeCl 3 2 :该固体物质是 FeCl 3 FeCl 3 3假设 3 :该固体物质是
假设 3 :该固体物质是 3 :该固体物质是⑵ 设计实验方案:
⑵ 设计实验方案: 设计实验方案:取少量固体物质置于烧杯中,加适量水溶解,得到溶液 A ,然后取两份 A 溶液分别进行实验,实验现象与结论如下表:
取少量固体物质置于烧杯中,加适量水溶解,得到溶液 A ,然后取两份 A 溶液分别进行实验,实验现象与结论如下表: A ,然后取两份 A 溶液分别进行实验,实验现象与结论如下表: A 溶液分别进行实验,实验现象与结论如下表:| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN 溶液 |
| 固体物质中有 FeCl 3 |
| 在 KMnO 4 溶液中加少量 A 溶液 | KmnO 4 溶液颜色无明显变化 | 固体物质中不含 |
实验方法
实验现象
结论
在溶液中加 KSCN 溶液
固体物质中有 FeCl 3
在 KMnO 4 溶液中加少量 A 溶液
KmnO 4 溶液颜色无明显变化
固体物质中不含
实验方法
实验现象
结论
实验方法
实验方法
实验方法实验现象
实验现象
实验现象结论
结论
结论在溶液中加 KSCN 溶液
固体物质中有 FeCl 3
在溶液中加 KSCN 溶液
在溶液中加 KSCN 溶液
在溶液中加 KSCN 溶液 KSCN 溶液
固体物质中有 FeCl 3
固体物质中有 FeCl 3
固体物质中有 FeCl 3 FeCl 3 3在 KMnO 4 溶液中加少量 A 溶液
KmnO 4 溶液颜色无明显变化
固体物质中不含
在 KMnO 4 溶液中加少量 A 溶液
在 KMnO 4 溶液中加少量 A 溶液
在 KMnO 4 溶液中加少量 A 溶液 KMnO 4 溶液中加少量 A 溶液 4 A 溶液KmnO 4 溶液颜色无明显变化
KmnO 4 溶液颜色无明显变化
KmnO 4 溶液颜色无明显变化 4 溶液颜色无明显变化固体物质中不含
固体物质中不含
固体物质中不含Ⅱ. 电子工业常用 30% 的 FeCl 3 溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得 FeCl 3 溶液,设计了下列实验步骤:
Ⅱ. 电子工业常用 30% 的 FeCl 3 溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得 FeCl 3 溶液,设计了下列实验步骤: 电子工业常用 30% 的 FeCl 3 溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得 FeCl 3 溶液,设计了下列实验步骤: 30% 的 FeCl 3 溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得 FeCl 3 溶液,设计了下列实验步骤: FeCl 3 溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得 FeCl 3 溶液,设计了下列实验步骤: 3 FeCl 3 溶液,设计了下列实验步骤: 3 


⑶① 写出一个能证明还原性 Fe 比 Cu 强的离子方程式: ,该反应在上图步骤 中发生。
⑶① 写出一个能证明还原性 Fe 比 Cu 强的离子方程式: ,该反应在上图步骤 中发生。 写出一个能证明还原性 Fe 比 Cu 强的离子方程式: ,该反应在上图步骤 中发生。 Fe 比 Cu 强的离子方程式: ,该反应在上图步骤 中发生。 Cu 强的离子方程式: ,该反应在上图步骤 中发生。②甲、乙、丙、丁四位同学利用上述反应原理,分别设计的原电池如下图所示:
②甲、乙、丙、丁四位同学利用上述反应原理,分别设计的原电池如下图所示: 





四位同学的设计的原电池装置图,符合上述反应原理的是 。
四位同学的设计的原电池装置图,符合上述反应原理的是 。③ 请写出正、负极的电解反应式:
③ 请写出正、负极的电解反应式: 请写出正、负极的电解反应式:正极: 、负极: (电极反应式)。
正极: 、负极: (电极反应式)。⑷上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式
⑷上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式⑴ FeCl 2 和 FeCl 3 ; ⑵ 溶液呈红色; FeCl 2 ; ⑶①Fe + Cu 2 + = Fe 2+ + Cu ; ① ; ② 甲、丙、丁; ③Cu 2 + +2e - =Cu ; Fe - 2e - =Fe 2 + ; ⑷ 粗铜; Cu-2e - =Cu 2+ 。
解析 : I . 根据铁与硝酸在不同条件下可被氧化成两种产物,推断铁粉与 Cl 2 反应也可能生成 FeCl 2 或 FeCl 3 或两种物质的混合物。根据 KSCN 溶液能与 Fe 3 + 显红色,可检验产物中是否含有 FeCl 3 。根据酸性 KMnO 4 溶液能氧化 Fe 2 + 而退色,可验证产物中是否含有 FeCl 2 。
Ⅱ. 从腐蚀废液中回收铜的实验过程如下:

利用 Fe 能从 CuCl 2 溶液中置换出铜,来证明 Fe 比 Cu 的还原性强。反应方程式为: Fe + CuCl 2 = Cu + FeCl 2 。用该反应设计原电池时可用 Fe 作负极, Cu (或者碳)作正极, CuCl 2 溶液后 CuSO 4 溶液作电解质的溶液。电解精炼铜时,粗铜作阳极 (Cu-2e - =Cu 2+ ) ,纯铜作阴极 (Cu 2 + + 2e - →Cu) ,含 Cu 2 + 的溶液作电解质的溶液。
⑴ FeCl 2 和 FeCl 3 ; ⑵ 溶液呈红色; FeCl 2 ; ⑶①Fe + Cu 2 + = Fe 2+ + Cu ; ① ; ② 甲、丙、丁; ③Cu 2 + +2e - =Cu ; Fe - 2e - =Fe 2 + ; ⑷ 粗铜; Cu-2e - =Cu 2+ 。
⑴ FeCl 2 2 和 FeCl 3 3 ; ⑵ 溶液呈红色; FeCl 2 2 ; ⑶①Fe + Cu 2 2 + + = Fe 2+ 2+ + Cu ; ① ; ② 甲、丙、丁; ③Cu 2 2 + + +2e - - =Cu ; Fe - 2e - - =Fe 2 2 + + ; ⑷ 粗铜; Cu-2e - - =Cu 2+ 2+ 。解析 : I . 根据铁与硝酸在不同条件下可被氧化成两种产物,推断铁粉与 Cl 2 反应也可能生成 FeCl 2 或 FeCl 3 或两种物质的混合物。根据 KSCN 溶液能与 Fe 3 + 显红色,可检验产物中是否含有 FeCl 3 。根据酸性 KMnO 4 溶液能氧化 Fe 2 + 而退色,可验证产物中是否含有 FeCl 2 。
解析 : 解析 : I . 根据铁与硝酸在不同条件下可被氧化成两种产物,推断铁粉与 Cl 2 2 反应也可能生成 FeCl 2 2 或 FeCl 3 3 或两种物质的混合物。根据 KSCN 溶液能与 Fe 3 3 + + 显红色,可检验产物中是否含有 FeCl 3 3 。根据酸性 KMnO 4 4 溶液能氧化 Fe 2 2 + + 而退色,可验证产物中是否含有 FeCl 2 2 。Ⅱ. 从腐蚀废液中回收铜的实验过程如下:
Ⅱ. 从腐蚀废液中回收铜的实验过程如下: 

利用 Fe 能从 CuCl 2 溶液中置换出铜,来证明 Fe 比 Cu 的还原性强。反应方程式为: Fe + CuCl 2 = Cu + FeCl 2 。用该反应设计原电池时可用 Fe 作负极, Cu (或者碳)作正极, CuCl 2 溶液后 CuSO 4 溶液作电解质的溶液。电解精炼铜时,粗铜作阳极 (Cu-2e - =Cu 2+ ) ,纯铜作阴极 (Cu 2 + + 2e - →Cu) ,含 Cu 2 + 的溶液作电解质的溶液。
利用 Fe 能从 CuCl 2 2 溶液中置换出铜,来证明 Fe 比 Cu 的还原性强。反应方程式为: Fe + CuCl 2 2 = Cu + FeCl 2 2 。用该反应设计原电池时可用 Fe 作负极, Cu (或者碳)作正极, CuCl 2 2 溶液后 CuSO 4 4 溶液作电解质的溶液。电解精炼铜时,粗铜作阳极 (Cu-2e - - =Cu 2+ 2+ ) ,纯铜作阴极 (Cu 2 2 + + + 2e - - →Cu) ,含 Cu 2 2 + + 的溶液作电解质的溶液。数学上一般用f(x)来表示关于x的函数,若存在x∈R,使f(x)=x则称x为f(x)的不动点.已知 2020-05-13 …
悬挂一物体P,绳的拉力为F,物体的重力为G,则下列说法正确的是()A,F与G大小相等,且方向相反. 2020-05-21 …
在光滑的水平面上,有两个相互接触的物体:Mm.已知M>m.第一次用水平力F向右推M,物体间互相作用 2020-05-23 …
已知果蝇中,灰身与黑身是一对相对形状(基因用B、b表示);直毛与分叉毛为一对相对形状(基因用F、f 2020-06-15 …
(2009•江门一模)已知果蝇中,灰身与黑身是一对相对性状(相关基因用B.b表示),直毛与分叉毛是 2020-06-26 …
已知果蝇灰身与黑身是一对相对性状(相关基因用E、e表示),直毛与分叉毛是一对相对性状(相关基因用F 2020-07-06 …
设fx=a1sin(x+a1)+a2sin(x+a1)+ansin(x+an)f(x1)=f(x2 2020-07-18 …
同在对于法则F下的范围相同,同在对于法则F下的范围相同,即f(x),f[g(x)]f[h(x)]三个 2020-11-07 …
两个人分别用F拉绳的两端为什么和把绳的一端固定,一个人用F拉另一端作用相同?第二问是这个绳子不能受超 2020-11-08 …
函数y=f(x)和函数和初中的y=x之类的函数有什么区别?其中,f是什么意思,初中的函数用f(x)怎 2021-02-01 …