早教吧作业答案频道 -->化学-->
从含铜废料(如:覆铜板、印刷线路板及铅冰铜等)中提取铜,既可提高资源的利用率又可减少重金属污染.(1)废覆铜板(Cu和Sn组成)可用CuSO4和H2SO4混合溶液作电解质溶液,直接电解回
题目详情
从含铜废料(如:覆铜板、印刷线路板及铅冰铜等)中提取铜,既可提高资源的利用率又可减少重金属污染.
(1)废覆铜板(Cu和Sn组成)可用CuSO4和H2SO4混合溶液作电解质溶液,直接电解回收精铜,阳极上发生的电极反应为___.
(2)废印刷线路板中的铜常用含盐酸的FeCl3溶液或H2O2-HCl-NaCl混合溶液浸取回收.
①用FeCl3溶液浸取铜时发生反应的离子方程式为___;若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀,产生红褐色沉淀的原因是___.
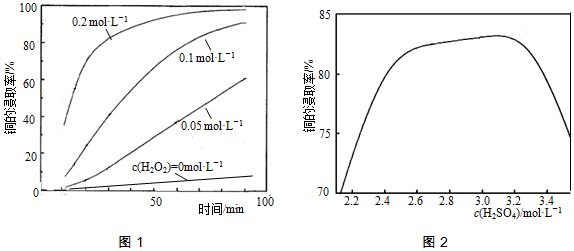
②将粉碎后的废印刷线路板放入三口烧瓶中,分别加入由0.3mol•L-1盐酸、0.5mol•L-1NaCl及不同浓度的H2O2组成的混合溶液,在温度、搅拌速率及固液比等均相同时,铜的浸取率随H2O2的浓度和时间的变化如图1所示.当c(H2O2)=0mol•L-1时,也有少量的铜被浸出,其原因是___.
③用H2O2-HCl-NaCl混合溶液浸取时,其浸取过程包括:
(Ⅰ) Cu+H2O2+2H+=Cu2++2H2O
(Ⅱ) Cu2++Cu⇌2Cu+
(Ⅲ) Cu++nCl-⇌CuCln(n-1)-
(Ⅳ) 2CuCln(n-1)-+2H++H2O2=2Cu2++2H2O+2nCl-
其他条件相同时,增大下列离子浓度可以加速Cu从废电路板中浸出的是___(填序号).
a.Na+ b.Cu2+ c.Cl-d.OH-
(3)铅冰铜(PbS、Cu2S及FeS的混合物)可用HCl-H2O2混合溶液浸取.
①Cu2S被HCl-H2O2混合溶液浸取得到硫酸铜和氯化铜溶液的化学方程式为___.
②若由H2SO4代替HCl-H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图2所示.当H2SO4浓度大于3.1mol•L-1时,硫酸浓度越大,铜的浸取率反而越小,其原因可能是___.
(1)废覆铜板(Cu和Sn组成)可用CuSO4和H2SO4混合溶液作电解质溶液,直接电解回收精铜,阳极上发生的电极反应为___.
(2)废印刷线路板中的铜常用含盐酸的FeCl3溶液或H2O2-HCl-NaCl混合溶液浸取回收.
①用FeCl3溶液浸取铜时发生反应的离子方程式为___;若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀,产生红褐色沉淀的原因是___.
②将粉碎后的废印刷线路板放入三口烧瓶中,分别加入由0.3mol•L-1盐酸、0.5mol•L-1NaCl及不同浓度的H2O2组成的混合溶液,在温度、搅拌速率及固液比等均相同时,铜的浸取率随H2O2的浓度和时间的变化如图1所示.当c(H2O2)=0mol•L-1时,也有少量的铜被浸出,其原因是___.
③用H2O2-HCl-NaCl混合溶液浸取时,其浸取过程包括:
(Ⅰ) Cu+H2O2+2H+=Cu2++2H2O
(Ⅱ) Cu2++Cu⇌2Cu+
(Ⅲ) Cu++nCl-⇌CuCln(n-1)-
(Ⅳ) 2CuCln(n-1)-+2H++H2O2=2Cu2++2H2O+2nCl-
其他条件相同时,增大下列离子浓度可以加速Cu从废电路板中浸出的是___(填序号).
a.Na+ b.Cu2+ c.Cl-d.OH-

(3)铅冰铜(PbS、Cu2S及FeS的混合物)可用HCl-H2O2混合溶液浸取.
①Cu2S被HCl-H2O2混合溶液浸取得到硫酸铜和氯化铜溶液的化学方程式为___.
②若由H2SO4代替HCl-H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图2所示.当H2SO4浓度大于3.1mol•L-1时,硫酸浓度越大,铜的浸取率反而越小,其原因可能是___.
▼优质解答
答案和解析
(1)电解法精炼铜,阳极为活性电极,电极本身参与放电,铜失去电子发生氧化反应,电极反应式:Cu-2e-=Cu2+;锡失去电子生成锡离子,电极反应式:Sn-2e-=Sn2+;
故答案为:Cu-2e-=Cu2+ 和Sn-2e-=Sn2+;
(2)①三价铁离子能够氧化铜生成铜离子,本身被还原为二价铁离子,离子方程式:2Fe3++Cu=2Fe2++Cu2+;
若加盐酸不足,溶液中氢离子浓度较小,三价铁离子水解生成氢氧化铁,所以若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀;
故答案为:2Fe3++Cu=2Fe2++Cu2+;
c(H+)和c(Fe3+)小,有利于Fe3+水解生成Fe(OH)3沉淀;
②当c(H2O2)=0mol•L-1时,液面上方空气中O2随搅拌不断进入溶液,溶解的O2将铜氧化而被浸取,所以也有少量的铜被浸出;
故答案为:液面上方空气中O2随搅拌不断进入溶液,溶解的O2将铜氧化而被浸取;
③a.依据给出的方程式可知,上述反应与钠离子都无关,所以改变钠离子的浓度,不影响Cu从废电路板中浸出,故a不选;
b.由Cu2++Cu⇌2Cu+可知增大铜离子浓度,上述反应的速率加快,故b选;
c.由Cu++nCl-⇌CuCln(n-1)-可知增大Cl-浓度,反应Ⅲ加快,故c选;
d.氢氧根离子能够与氢离子、铜离子反应,增大氢氧根离子浓度,能够使氢离子、铜离子浓度减小,反应速率减慢,故d不选;
故选:bc;
(3)①Cu2S在盐酸的酸性环境下被过氧化氢生成硫酸铜、氯化铜和水,依据得失电子守恒,原子个数守恒反应的方程式为:Cu2S+5H2O2+2HCl=CuCl2+CuSO4+6H2O;
故答案为:Cu2S+5H2O2+2HCl=CuCl2+CuSO4+6H2O;
②由H2SO4代替HCl-H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图2所示.当H2SO4浓度大于3.1mol•L-1时,过量的硫酸会生成PbSO4沉淀包裹在铅冰铜颗粒表面,使铜无法与浸出液接触,使得硫酸浓度越大,铜的浸取率反而越小;
故答案为:过量的硫酸会生成PbSO4沉淀包裹在铅冰铜颗粒表面,使铜无法与浸出液接触;
故答案为:Cu-2e-=Cu2+ 和Sn-2e-=Sn2+;
(2)①三价铁离子能够氧化铜生成铜离子,本身被还原为二价铁离子,离子方程式:2Fe3++Cu=2Fe2++Cu2+;
若加盐酸不足,溶液中氢离子浓度较小,三价铁离子水解生成氢氧化铁,所以若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀;
故答案为:2Fe3++Cu=2Fe2++Cu2+;
c(H+)和c(Fe3+)小,有利于Fe3+水解生成Fe(OH)3沉淀;
②当c(H2O2)=0mol•L-1时,液面上方空气中O2随搅拌不断进入溶液,溶解的O2将铜氧化而被浸取,所以也有少量的铜被浸出;
故答案为:液面上方空气中O2随搅拌不断进入溶液,溶解的O2将铜氧化而被浸取;
③a.依据给出的方程式可知,上述反应与钠离子都无关,所以改变钠离子的浓度,不影响Cu从废电路板中浸出,故a不选;
b.由Cu2++Cu⇌2Cu+可知增大铜离子浓度,上述反应的速率加快,故b选;
c.由Cu++nCl-⇌CuCln(n-1)-可知增大Cl-浓度,反应Ⅲ加快,故c选;
d.氢氧根离子能够与氢离子、铜离子反应,增大氢氧根离子浓度,能够使氢离子、铜离子浓度减小,反应速率减慢,故d不选;
故选:bc;
(3)①Cu2S在盐酸的酸性环境下被过氧化氢生成硫酸铜、氯化铜和水,依据得失电子守恒,原子个数守恒反应的方程式为:Cu2S+5H2O2+2HCl=CuCl2+CuSO4+6H2O;
故答案为:Cu2S+5H2O2+2HCl=CuCl2+CuSO4+6H2O;
②由H2SO4代替HCl-H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图2所示.当H2SO4浓度大于3.1mol•L-1时,过量的硫酸会生成PbSO4沉淀包裹在铅冰铜颗粒表面,使铜无法与浸出液接触,使得硫酸浓度越大,铜的浸取率反而越小;
故答案为:过量的硫酸会生成PbSO4沉淀包裹在铅冰铜颗粒表面,使铜无法与浸出液接触;
看了 从含铜废料(如:覆铜板、印刷...的网友还看了以下:
菲利普斯曲线可解释货币政策最终目标之间的矛盾关系,它是( )。A.稳定物价与充分就业 B.充分就 2020-05-19 …
平面上有一天O,以O为顶点引出两条射线,可组成1个角,引出3条射线,可组成3个角,引出4条射线,可 2020-05-20 …
1.当光线射到x轴的点C后进行反射,如果反射的路径经过点A(0,1)和点B(3,4),则入射光线所 2020-05-23 …
初一数学一只蚂蚁行走的路线可解释为武术中常说的棍扫一大片可解释为将三角尺绕着他的一条直角边旋转可解 2020-06-03 …
飞机表演“飞机拉线”,我们用数学知识可解释为点动成线.那么请用数学知识解释下列现象!(1)一只小蚂 2020-06-17 …
如果直线OA平行直线O'A',直线OB平行直线O'B',那么角AOB和角A'O'B'可能互补吗?为 2020-07-24 …
如图,抛物线y=ax2+bx+c经过点O(0,0),A(4,0),B(5,5).点C是y轴负半轴上 2020-07-26 …
开口向下的抛物线经过原点O和点E(4,0),顶点P到x轴的距离为4.点A(a,0)是线段OE上一点 2020-07-29 …
(2014•吉林)如图,四边形OABC是平行四边形,以O为圆心,OA为半径的圆交AB于点D,延长AO 2020-11-12 …
在比赛中,某次羽毛球的运动路线可以看作是抛物线y=-14x2+bx+c的一部分,如图,其中出球点B离 2020-11-21 …