早教吧作业答案频道 -->化学-->
能源问题是人类社会面临的重大课题.甲醇是未来重要的绿色能源之一.以CH4和H2O为原料,通过下列反应来制备甲醇.Ⅰ.CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.0kJ/molⅡ.CO(g)+2H2(g)
题目详情
能源问题是人类社会面临的重大课题.甲醇是未来重要的绿色能源之一.以CH4和H2O为原料,通过下列反应来制备甲醇.
Ⅰ.CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.0kJ/mol
Ⅱ.CO(g)+2H2(g)═CH3OH(g)△H=-129.0kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为___.
(2)将1.0molCH4和2.0molH2O(g)通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的平衡转化率与温度的关系如图1.
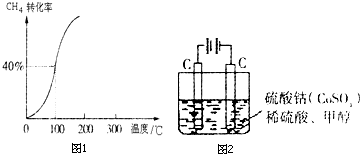
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应在0~5min内的平均速率为___;
②100℃时反应I的平衡常数为___.
(3)在压强为0.1MPa、温度为300℃条件下,将1.0molCO和2.0molH2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的
,其他条件不变,对平衡体系产生的影响是___(填字母序号).
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢 c.CH3OH的物质的量增加
d.重新平衡时c(H2)/c(CH3OH)减小 e.平衡常数K增大
(4)甲醇在工业上用途很多
①甲醇蒸气重整法制备氢气:该法中的一个主要反应为CH3OH(g)═CO(g)+2H2(g),一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是___.
a.2v逆(CO)=v正(H2) b.CH3OH的 百分含量不再变
c.混合气体密度保持不变 d.c(CO):c(H2):c(CH3OH)=1:2:1
②甲醇可用制作燃料电池的燃料:写出以熔融碳酸盐(如:熔融K2CO3)为电解质的电池负极反应___,其中K+向___极移动.
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图2装置模拟上述过程:
①写出阳极电极反应式___;
②写出除去甲醇的离子方程式___.
③若该电解槽用铅蓄电池为电源,则除去32g甲醇至少需要消耗___g铅.
Ⅰ.CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.0kJ/mol
Ⅱ.CO(g)+2H2(g)═CH3OH(g)△H=-129.0kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为___.
(2)将1.0molCH4和2.0molH2O(g)通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的平衡转化率与温度的关系如图1.

①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应在0~5min内的平均速率为___;
②100℃时反应I的平衡常数为___.
(3)在压强为0.1MPa、温度为300℃条件下,将1.0molCO和2.0molH2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的
| 1 |
| 2 |
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢 c.CH3OH的物质的量增加
d.重新平衡时c(H2)/c(CH3OH)减小 e.平衡常数K增大
(4)甲醇在工业上用途很多
①甲醇蒸气重整法制备氢气:该法中的一个主要反应为CH3OH(g)═CO(g)+2H2(g),一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是___.
a.2v逆(CO)=v正(H2) b.CH3OH的 百分含量不再变
c.混合气体密度保持不变 d.c(CO):c(H2):c(CH3OH)=1:2:1
②甲醇可用制作燃料电池的燃料:写出以熔融碳酸盐(如:熔融K2CO3)为电解质的电池负极反应___,其中K+向___极移动.
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图2装置模拟上述过程:
①写出阳极电极反应式___;
②写出除去甲醇的离子方程式___.
③若该电解槽用铅蓄电池为电源,则除去32g甲醇至少需要消耗___g铅.
▼优质解答
答案和解析
(1)依据盖斯定律结合题干热化学方程式计算得到;①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol;②CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol
①-②得到CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0kJ/mol;
故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0kJ/mol;
(2)①100°时甲烷的转化率为40%,变化的甲烷为0.4mol,生成的氢气依据反应①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol;可知氢气物质的量为1.2mol,用H2表示该反应的平均反应速率=
=0.0024mol/(L•min);故答案为:0.0024mol/(L•min);
②依据化学平衡三段式计算平衡浓度、根据平衡常数的概念计算得到
CH4(g)+H2O(g)=CO(g)+3H2(g)
起始量(mol/L)0.01 0.02 0 0
变化量(mol/L) 0.004 0.004 0.004 0.012
平衡量(mol/L)0.006 0.016 0.004 0.012
K=
=
=7.2×10-5(mol/L)2
故答案为:7.2×10-5(mol/L)2;
(3)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol;
平衡后将容器的容积压缩到原来的
,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行
a、体积减小,c(H2)增大,故a错误;
b、压强增大,正逆反应速率都加快,故b错误;
c、体积减小,压强增大,平衡正向进行,CH3OH的物质的量增加,故c正确;
d、体积减小,压强增大,平衡正向进行,重新平衡时
减小,故d正确;
e、平衡常数K只随温度的而变化,故e错误;
故选cd;
(4)①恒温恒容的容器内进行反应CH3OH(g)═CO(g)+2H2(g),
a.2v逆(CO)=v正(H2),正逆反应速率相等,证明反应达到平衡,故正确;
b.CH3OH的百分含量不再变是平衡的特征,故正确;
c.混合气体的密度等于气体质量和容器体积的比值,反应过程中气体质量守恒,容器体积相同,密度不变,不能证明反应达到平衡,故错误;
d.c(CO):c(H2):c(CH3OH)=1:2:1不能证明反应达到了平衡,故错误.
故选ab;
②负极上甲醇失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为CH3OH-6e-+3CO32-=4CO2+2H2O,燃料电池中,电解质中的阳离子移向正极,即钾离子移向正极.
故答案为:CH3OH-6e-+3CO32-=4CO2+2H2O;正;
(5)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;故答案为:Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化的离子方程式结合氧化还原反应的实质原子守恒,电荷守恒配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
③若该电解槽用铅蓄电池为电源,Pb负极的反应为:Pb+SO42--2e-=PbSO4,根据反应原理:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+则除去32g甲醇转移电子是
6mol,所以至少需要消耗金属铅是3mol,质量是3mol×207g/mol=621g,故答案为:621.
①-②得到CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0kJ/mol;
故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0kJ/mol;
(2)①100°时甲烷的转化率为40%,变化的甲烷为0.4mol,生成的氢气依据反应①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol;可知氢气物质的量为1.2mol,用H2表示该反应的平均反应速率=
| ||
| 5min |
②依据化学平衡三段式计算平衡浓度、根据平衡常数的概念计算得到
CH4(g)+H2O(g)=CO(g)+3H2(g)
起始量(mol/L)0.01 0.02 0 0
变化量(mol/L) 0.004 0.004 0.004 0.012
平衡量(mol/L)0.006 0.016 0.004 0.012
K=
| c(CO)•c3(H2) |
| c(CH4)•c(H2O) |
| 0.004×0.0123 |
| 0.006×0.016 |
故答案为:7.2×10-5(mol/L)2;
(3)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol;
平衡后将容器的容积压缩到原来的
| 1 |
| 2 |
a、体积减小,c(H2)增大,故a错误;
b、压强增大,正逆反应速率都加快,故b错误;
c、体积减小,压强增大,平衡正向进行,CH3OH的物质的量增加,故c正确;
d、体积减小,压强增大,平衡正向进行,重新平衡时
| c(H2) |
| c(CH3OH) |
e、平衡常数K只随温度的而变化,故e错误;
故选cd;
(4)①恒温恒容的容器内进行反应CH3OH(g)═CO(g)+2H2(g),
a.2v逆(CO)=v正(H2),正逆反应速率相等,证明反应达到平衡,故正确;
b.CH3OH的百分含量不再变是平衡的特征,故正确;
c.混合气体的密度等于气体质量和容器体积的比值,反应过程中气体质量守恒,容器体积相同,密度不变,不能证明反应达到平衡,故错误;
d.c(CO):c(H2):c(CH3OH)=1:2:1不能证明反应达到了平衡,故错误.
故选ab;
②负极上甲醇失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为CH3OH-6e-+3CO32-=4CO2+2H2O,燃料电池中,电解质中的阳离子移向正极,即钾离子移向正极.
故答案为:CH3OH-6e-+3CO32-=4CO2+2H2O;正;
(5)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;故答案为:Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化的离子方程式结合氧化还原反应的实质原子守恒,电荷守恒配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
③若该电解槽用铅蓄电池为电源,Pb负极的反应为:Pb+SO42--2e-=PbSO4,根据反应原理:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+则除去32g甲醇转移电子是
6mol,所以至少需要消耗金属铅是3mol,质量是3mol×207g/mol=621g,故答案为:621.
看了 能源问题是人类社会面临的重大...的网友还看了以下:
麻烦大家看两道题麻烦大家看下下面这两道题,说一下解题思路,谢谢!1.某一般纳税企业本期购入原材料, 2020-04-07 …
选择题中这个选项为什么不对?氢气和氧气在点燃的情况下生成水基础训练上原题是(而且老师都说答案正确) 2020-05-16 …
帮我看看原题是:某校办工厂将质量相等,总价值分别为2000元和4800元的甲,乙原料混合后,其平均 2020-05-20 …
单选题:下列各项属于产品成本项目的是a原材料b外购材料c外购动力d折旧费单选题:下列各项属于产品成 2020-06-19 …
会计问题某工业企业采用计划成本进行原材料的核算。2010年1月初结存原材料的计划成本为100000 2020-07-14 …
关于材料成本差异的问题某企业采用计划成本进行原材料的核算。2015年1月初结存原材料的计划成本为1 2020-07-16 …
不懂的两个会计题,请大家帮忙,麻烦详细解答。谢了~~第一题:某单位“原材料”总账账户下设A材料和B材 2020-11-07 …
阅读材料,回答问题。几年前,由于国际原油市场价格快速上涨,直接导致纺织企业的原材料涤纶和氨纶价格直线 2020-12-02 …
英语问题bemadeof/fromThepaperismadefromwood.这个句子是没错,be 2020-12-02 …
会计题目求解释某企业采用计划成本进行原材料的核算。2008年4月初结存原材料的计划成本为20万元.本 2020-12-07 …