(14分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:(1)此流程的第II步反应为:CO(g)+H2O(g)H2(g)+CO2(g),该反应的平衡常数随温度的变
(14分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:
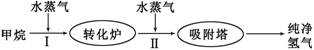
(1)此流程的第II步反应为:CO(g)+H 2 O(g) H 2 (g)+CO 2 (g),该反应的平衡常数随温度的变化如下表:
H 2 (g)+CO 2 (g),该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数 K | 10 | 9 | 1 |
从上表可以推断:此反应是 (填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入1mo1CO和2mo1H 2 O,则达到平衡后CO的转化率为 。
(2)在500℃,以下表的物质的量(按照CO、H 2 O、H 2 、CO 2 的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是
| 实验编号 | 反应物投入量 | 平衡时H 2 浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c 1 | Q 1 | α 1[ 来源 :] |
| B | 0、0、2、2 | c 2 | Q 2 | α 2
|
| C | 2、2、0、0 | c 3 | Q 3 | α 3 |
A.2 c 1 = c 2 = c 3 B.2Q 1 =Q 2 =Q 3 C.α 1 =α 2 =α 3 D.α 1 +α 2 =1
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是 。
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥ v (CO 2 ) 正 = v (H 2 O) 逆
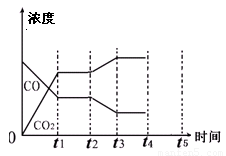
(4)下图表示此流程的第II步反应,在 t 1 时刻达到平衡、在 t 2 时刻因改变某个条件浓度发生变化的情况:图中 t 2 时刻发生改变的条件是 、
(写出两种)。若t 4 时刻通过改变容积的方法将压强增大为原先的两倍,在图中t 4 和t 5 区间内画出CO、CO 2 浓度变化曲线,并标明物质(假设各物质状态均保持不变)。
(1)温度越高,平衡常数越小,所以正反应是放热反应。 CO(g)+H2O(g)H2(g)+CO2(g) 起始量(mol) 1 2 0 0 转化量(mol) x x x x 平衡量(mol) 1-x 2-x x x 根据平衡常数知 解得x=2/3,所以平衡后CO的转化率为是66.7%。 (2)因为反应前后体积,即改变压强平衡不会发生移动,根据所给的反应物投入量来看ABC就是等效的,虽然氢气的含量,但氢气的浓度不同,其中BC相等且都是A的2倍。根据500℃平衡常数可计算出A中反应物的转化率均是75%
【计算方法同(1)】,即平衡时A中CO、H2O、H2、CO2分别是0.25mol、0.25mlol、0.75mol、0.75mol,则平衡时B、C中CO、H2O、H2、CO2分别都为0.5mol、0.5mol、1.5mol、1.5mol。即B、C中转化率分别是25%和75%。A中放热Q1,所以反应热是-2Q1kJ·mol-1。则C中放热2Q1,B中吸热Q1。答案AD正确。 (3)因为体系绝热,而反应是放热反应,所以压强会发生变化,①⑤可以。反应前后气体质量和容器的体积均不发生变化,所以密度不变,②不可以。反应前后气体质量和物质的量均不发生变化,所以相对分子质量不变,③不可以。④⑥符合化学平衡的概念正确。答案是②③。 (4)由图像可知t2时刻CO浓度减小,CO2浓度增大,因此改变的条件是降低温度,或增加水蒸汽的量。t4时刻通过改变容积的方法将压强增大为原先的两倍,平衡不移动,但物质的浓度均增大,都变为原来大2倍,如图所示
下列热化学方程式中,△H能正确表示物质的燃烧热的是A.CO(g)+1/2O2(g)==CO2(g) 2020-05-13 …
氨气的燃烧热的热化学方程式NH3(g)燃烧生成NO2和H2O,已知(1)H2(g)+1/2O2(g 2020-05-14 …
已知:△G=△H-T△S,△G为自由能变化,△H为焓变,T为热力学温度,△S熵变.当△G<0时反应 2020-06-12 …
自由能的变化(△G)是反应方向判断的复合判据:△G=△H-T△S,△G<0时反应正向自发进行.已知 2020-07-18 …
已知:2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ/mol下列说法不正确的是A. 2020-07-19 …
0.096kg碳完全燃烧可放出3134.4kJ热量,以下对此反应的热化学方程式中书写正确的是[]A 2020-07-20 …
设函数f,g,h∈R,且有f(x)=x+3,g(x)=2x+1,h(x)=x/2,求出f○g,g○ 2020-07-26 …
设f(x),g(x),h(x)是R上的任意实数函数,如下定义两个函数和(f·g)(x);对任意x∈R 2020-12-22 …
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:C(石墨)+O2(g)=CO2(g 2021-01-04 …
已知:H(g)+H(g)=H2(g)ΔH=-435.7kJ/mol,此热化学方程式包含的意义是A.氢 2021-01-23 …